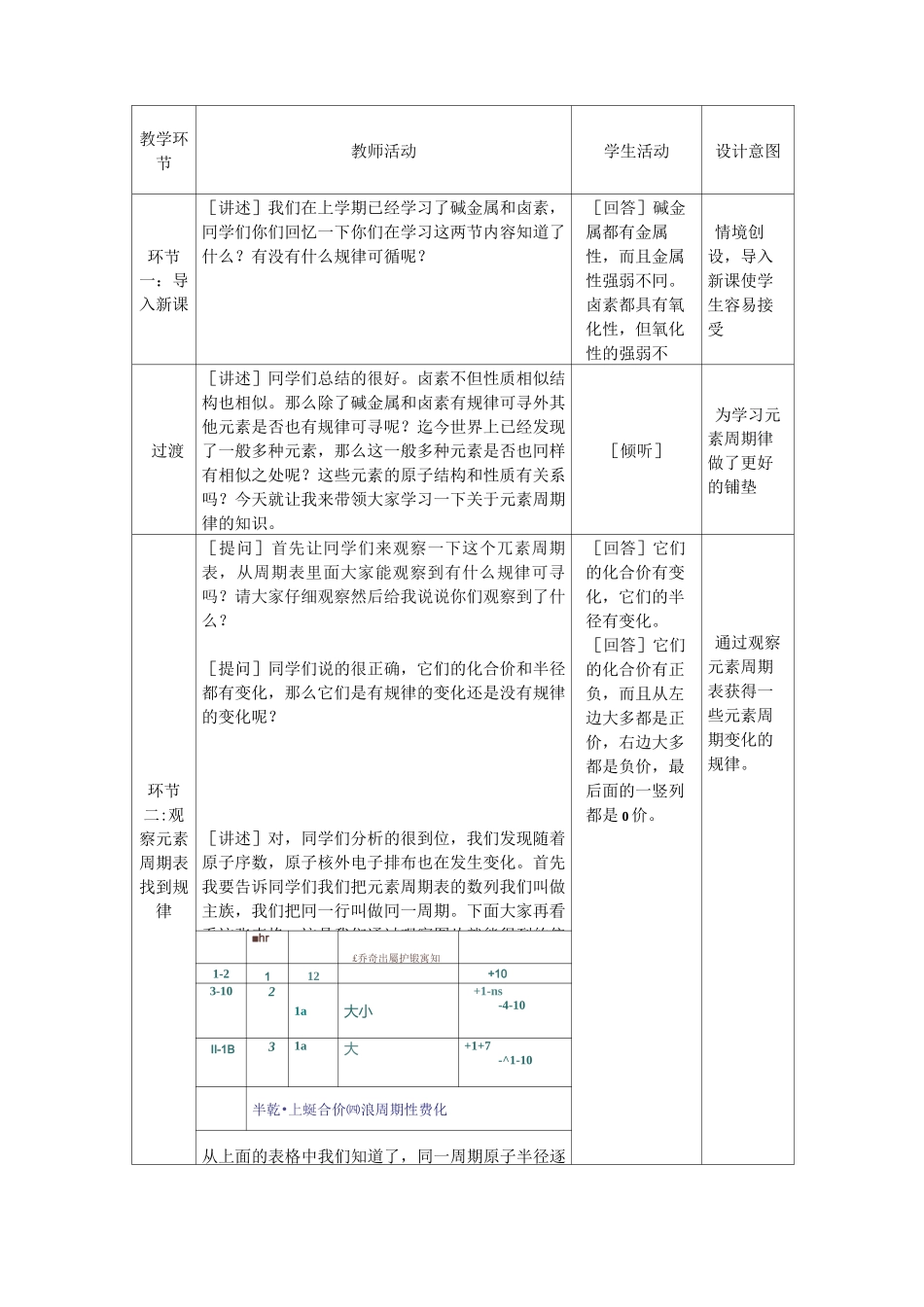
元素周期律教案一、教材分析本教材是利用已经学过的简单的元素以其化合物,如碱金属和卤素两类元素的知识,以及原子结构的理论知识,在此基础上引导学生揭示元素周期律和原子结构关系,从而揭示出元素周期律的实质。二、教学目标知识与技能方面:1.了解元素原子核外电子排布,原子半径,主要化合价,与元素金属性和非金属性的周期性变化。2.认识元素性质的周期性变化是元素原子核外电子排布周期性变化的结果,从而理解元素周期律的实质。过程与方法方面:通过学习元素周期律,培养学生的空间想象能力、归纳总结能力、类比推理能力。情感态度与价值观方面:通过引导观察比较,对比归纳的方法增强学生的学习兴趣和学习自信。三、教学重点和难点了解元素原子核外电子排布,原子半径,主要化合价,与元素金属性和非金属性的周期性变化是本节课的教学重点。认识元素性质周期性变化是元素核外电子排布周期性变化的结果,理解元素周期律的实质则是本节课的教学难点。四、教学方法本节课将采用启发式教学和引导讨论式的教学方法。五、教学过程教学环节教师活动学生活动设计意图环节一:导入新课[讲述]我们在上学期已经学习了碱金属和卤素,冋学们你们回忆一下你们在学习这两节内容知道了什么?有没有什么规律可循呢?[回答]碱金属都有金属性,而且金属性强弱不冋。卤素都具有氧化性,但氧化性的强弱不同。情境创设,导入新课使学生容易接受过渡[讲述]冋学们总结的很好。卤素不但性质相似结构也相似。那么除了碱金属和卤素有规律可寻外其他元素是否也有规律可寻呢?迄今世界上已经发现了一般多种元素,那么这一般多种元素是否也冋样有相似之处呢?这些元素的原子结构和性质有关系吗?今天就让我来带领大家学习一下关于元素周期律的知识。[倾听]为学习元素周期律做了更好的铺垫环节二:观察元素周期表找到规律[提问]首先让冋学们来观察一下这个兀素周期表,从周期表里面大家能观察到有什么规律可寻吗?请大家仔细观察然后给我说说你们观察到了什么?[提问]同学们说的很正确,它们的化合价和半径都有变化,那么它们是有规律的变化还是没有规律的变化呢?[讲述]对,同学们分析的很到位,我们发现随着原子序数,原子核外电子排布也在发生变化。首先我要告诉同学们我们把元素周期表的数列我们叫做主族,我们把冋一行叫做冋一周期。下面大家再看看这张表格。这是我们通过观察图片就能得到的信[回答]它们的化合价有变化,它们的半径有变化。[回答]它们的化合价有正负,而且从左边大多都是正价,右边大多都是负价,最后面的一竖列都是0价。通过观察元素周期表获得一些元素周期变化的规律。■hr£乔奇出屬护锻寓知1-2112+103-1021a大小+1-ns-4-10II-1B31a大+1+7-^1-10半乾•上蜒合价㈣浪周期性费化从上面的表格中我们知道了,同一周期原子半径逐渐减小,化合价先增加后减小。冋意主族兀素从上到下半径逐渐增大。过渡[讲述]冋学们知道了兀素周期表的一般规律,那么它们在性质上是否也呈周期性的变化呢?下面我们就来进行几个探究实验。大家首先请看课本第五页上面的信息提醒:元素的金属性和非金属性的强弱。在通常情况下,元素的金属性越强,它的单质越容易从水中或酸中置换氢,该元素最高价氧化物的水化物的碱性越强;元素的非金属性越强,它的单质越容易与氢气反应形成气态氰化物,气态氢化物越稳定,该元素最高价氧化物的水化物的酸性越强。[倾听、思考]环节二:兀素的性质和原子序数间的关系。{探究实验一}探究钠、镁、铝单质金属性的强弱。同学们你们知道如何判断金属性的强弱吗?请同学们在实验的同时仔细观察实验现象,填写实验记录表格,提醒大家一下实验一使我们上学期已经做过的实验,为了节省时间,同学们不再做这个实验,只要回忆以前实验现象填写实验记录表就可以了。实验前请同学们仔细阅读多PPT上面的实验步骤和注意事项,下面大豕开始实验。实验1:切取绿豆般大小的小块金属钠,用滤纸吸干其表面的煤油。在一只250ml烧杯中加入少量的水,在水中滴加两滴酚酞溶液,将金属钠投入烧杯中,观察并记录实验现象。实验2:将已用砂纸打磨除去氧化膜的小镁条放入试管中...