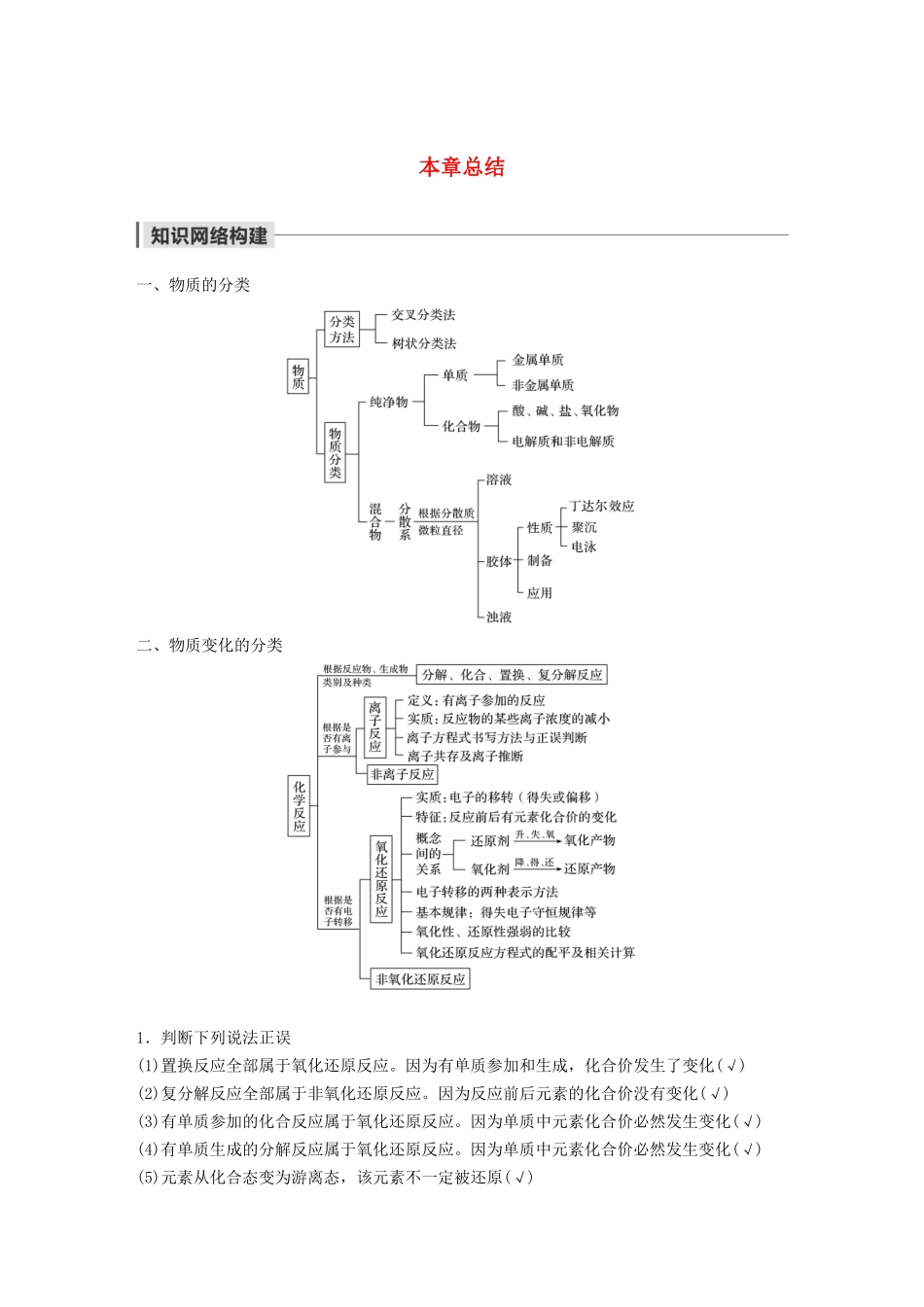
本章总结一、物质的分类二、物质变化的分类1.判断下列说法正误(1)置换反应全部属于氧化还原反应。因为有单质参加和生成,化合价发生了变化(√)(2)复分解反应全部属于非氧化还原反应。因为反应前后元素的化合价没有变化(√)(3)有单质参加的化合反应属于氧化还原反应。因为单质中元素化合价必然发生变化(√)(4)有单质生成的分解反应属于氧化还原反应。因为单质中元素化合价必然发生变化(√)(5)元素从化合态变为游离态,该元素不一定被还原(√)(6)失电子越多,还原性越强,得电子越多,氧化性越强(×)(7)金属元素被还原,不一定得到金属单质(√)(8)不容易得到电子的物质,肯定容易失去电子(×)2.写出下列反应的离子方程式(1)Fe与稀硫酸反应Fe+2H+===Fe2++H2↑。(2)石灰石与稀盐酸反应CaCO3+2H+===CO2↑+Ca2++H2O。(3)CuSO4溶液与Ba(OH)2溶液反应Cu2++SO+Ba2++2OH-===BaSO4↓+Cu(OH)2↓。(4)澄清石灰水通入CO2生成白色沉淀Ca2++2OH-+CO2===CaCO3↓+H2O。(5)碳酸钠溶液与足量盐酸反应CO+2H+===CO2↑+H2O。(6)碳酸钠溶液与Ba(OH)2溶液反应CO+Ba2+===BaCO3↓。(7)Zn粒置于CuSO4溶液中Zn+Cu2+===Zn2++Cu。(8)Mg(OH)2与盐酸反应Mg(OH)2+2H+===Mg2++2H2O。