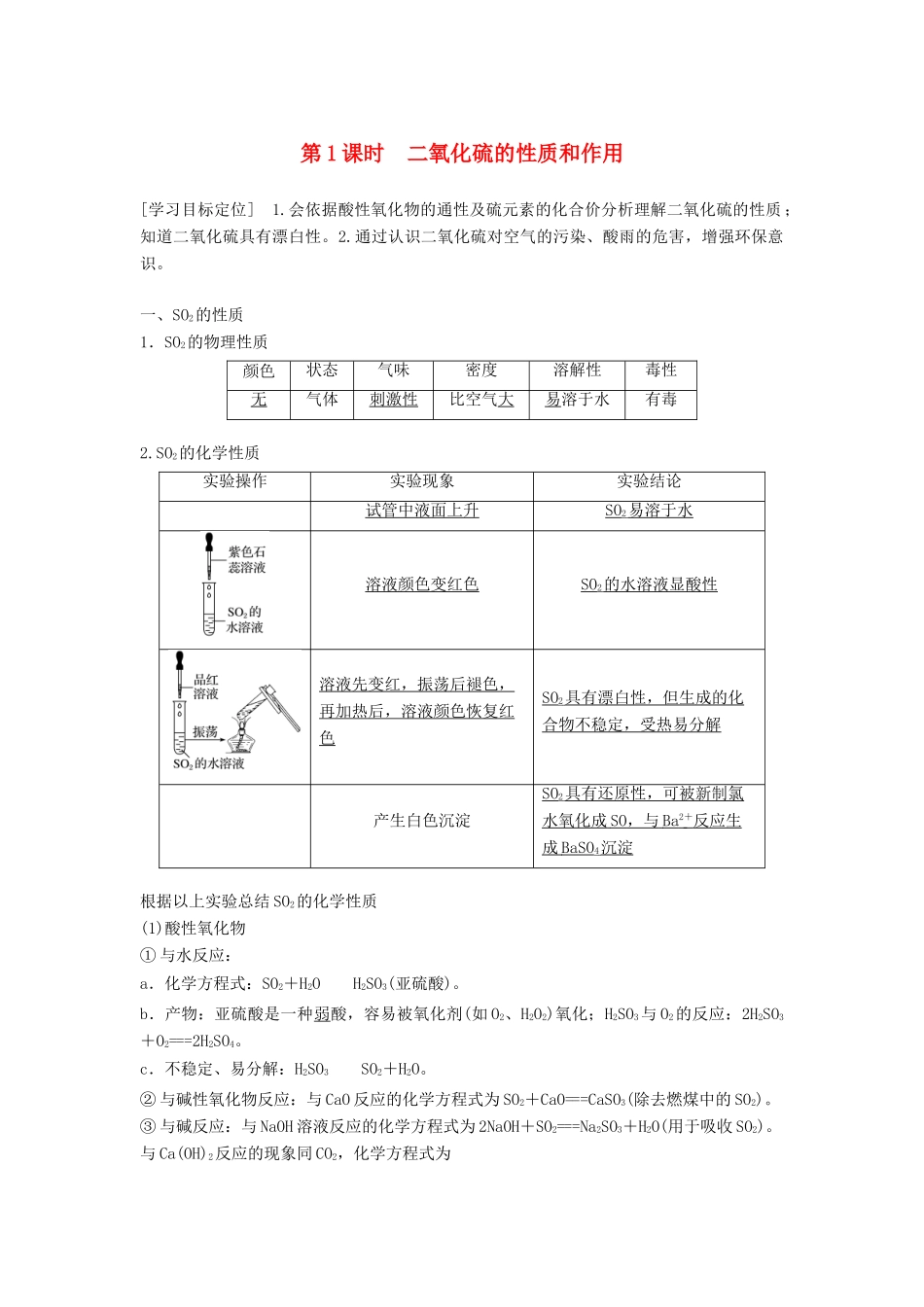
第1课时二氧化硫的性质和作用[学习目标定位]1.会依据酸性氧化物的通性及硫元素的化合价分析理解二氧化硫的性质;知道二氧化硫具有漂白性。2.通过认识二氧化硫对空气的污染、酸雨的危害,增强环保意识。一、SO2的性质1.SO2的物理性质颜色状态气味密度溶解性毒性无气体刺激性比空气大易溶于水有毒2.SO2的化学性质实验操作实验现象实验结论试管中液面上升SO2易溶于水溶液颜色变红色SO2的水溶液显酸性溶液先变红,振荡后褪色,再加热后,溶液颜色恢复红色SO2具有漂白性,但生成的化合物不稳定,受热易分解产生白色沉淀SO2具有还原性,可被新制氯水氧化成SO,与Ba2+反应生成BaSO4沉淀根据以上实验总结SO2的化学性质(1)酸性氧化物①与水反应:a.化学方程式:SO2+H2OH2SO3(亚硫酸)。b.产物:亚硫酸是一种弱酸,容易被氧化剂(如O2、H2O2)氧化;H2SO3与O2的反应:2H2SO3+O2===2H2SO4。c.不稳定、易分解:H2SO3SO2+H2O。②与碱性氧化物反应:与CaO反应的化学方程式为SO2+CaO===CaSO3(除去燃煤中的SO2)。③与碱反应:与NaOH溶液反应的化学方程式为2NaOH+SO2===Na2SO3+H2O(用于吸收SO2)。与Ca(OH)2反应的现象同CO2,化学方程式为Ca(OH)2+SO2===CaSO3↓+H2O、CaSO3+SO2+H2O===Ca(HSO3)2。(2)还原性SO2还原性较强,可被多种氧化剂[如O2、H2O2、X2(X=Cl、Br、I)、HNO3、KMnO4等]氧化。①与O2反应:2SO2+O2((((2SO3(可逆反应);②与H2O2反应:SO2+H2O2===H2SO4;③使酸性KMnO4溶液褪色;④使溴水褪色SO2+Br2+2H2O===H2SO4+2HBr。(3)弱氧化性SO2+2H2S===3S↓+2H2O。(4)漂白性二氧化硫能漂白某些有色物质,如品红。①原理:二氧化硫与某些有色物质反应,生成不稳定的无色物质。②特点:见光、加热或长久放置时,无色物质会分解恢复原来的颜色。提醒SO2能漂白品红、鲜花,不能漂白酸碱指示剂,SO2只能使紫色石蕊溶液变红。3.用途(1)漂白纸浆以及草帽等编织物。(2)制硫酸、作防腐剂、漂白剂及还原剂。【例1】下列说法正确的是()A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色B.能使品红溶液褪色的不一定是SO2C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同D.等物质的量的SO2和Cl2相遇在溶液中具有漂白能力答案B解析这道题是对有漂白性物质的漂白原理的综合考查。要正确解答本题,必须清楚常见漂白剂的漂白原理:Cl2、Na2O2、H2O2、O3等是因强氧化性而具有漂白性;SO2是因和某些有色物质化合生成无色物质;活性炭是因吸附作用而使物质褪色。思维启迪(1)SO2和Cl2同时作用于潮湿的有色物质的漂白性分析:SO2和Cl2同时作用于潮湿的有色物质时发生反应:SO2+Cl2+2H2O===2HCl+H2SO4。①n(Cl2)∶n(SO2)=1∶1,恰好完全反应生成盐酸和硫酸,无漂白性;②n(Cl2)∶n(SO2)>1∶1,Cl2过量,过量的Cl2起漂白作用,此时褪色后的物质加热时不恢复原色;③n(Cl2)∶n(SO2)<1∶1,SO2过量,过量的SO2起漂白作用,此时褪色后的物质加热时能恢复原色。(2)SO2虽有漂白性,但并不是所有与SO2有关的褪色都源于SO2的漂白性。如①SO2能使滴有酚酞的NaOH溶液褪色是因为SO2与碱发生反应;②SO2能使溴水和酸性KMnO4溶液褪色是因为SO2的还原性。二、硫酸型酸雨的形成及危害1.硫酸型酸雨的形成(1)酸雨:pH<5.6的降水被称为酸雨。正常雨水pH约为5.6,这是溶解了CO2的缘故。(2)形成原因:化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产等产生的废气中含有二氧化硫。(3)形成主要有两条途径:SO2反应的化学方程式分别为途径1:2SO2+O2催化剂,2SO3;SO3+H2O===H2SO4。途径2:SO2+H2OH2SO3;2H2SO3+O2===2H2SO4。2.酸雨的危害(1)酸化湖泊危害水生生物。(2)酸化土壤,降低土壤肥力,影响作物生长。(3)腐蚀建筑物。3.酸雨的防治(1)消除污染源,研究开发新能源(如太阳能、核能、氢能)。(2)对含硫燃料进行脱硫处理。(3)对含SO2废气进行处理或回收利用。用石灰乳吸收SO2的化学方程式为Ca(OH)2+SO2===CaSO3+H2O。酸雨的形成过程提醒燃煤脱硫反应:SO2+CaO=====CaSO3;2CaSO3+O2=====2CaSO4。【例2】某雨水样品刚采集时测得pH为4.82,放在烧杯...