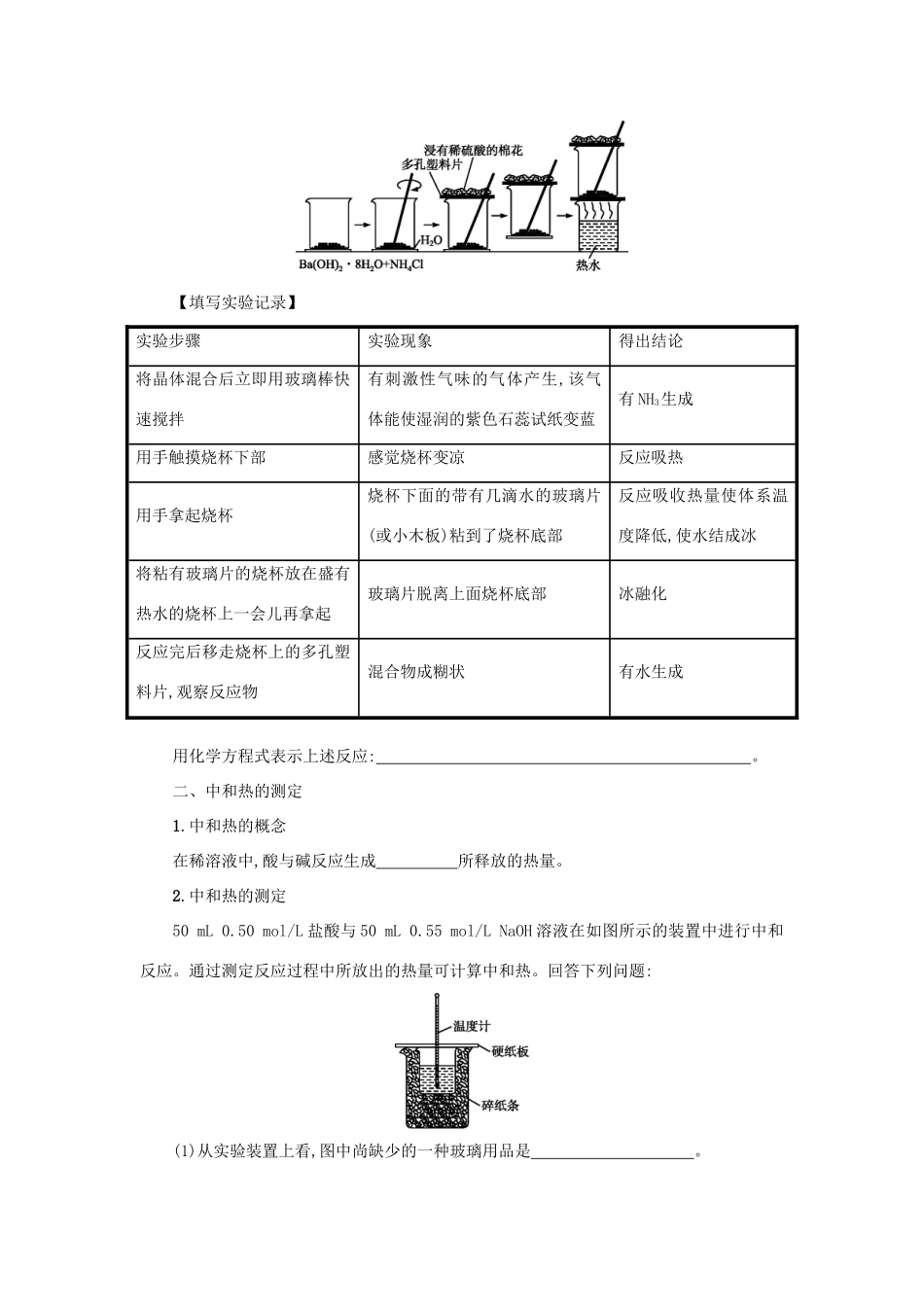
第2课时化学能与热能的相互转化学习目标1.通过分组实验,学会观察、记录实验现象,以及从分析现象中得出结论。2.掌握化学能与热能的相互转化的实验依据。3.巩固吸热反应、放热反应的概念,了解中和热的测定方法。自主学习1.请说出决定一个化学反应是放热还是吸热的因素是什么(要求从两个方面进行说明)。2.2Al+6HCl2AlCl3+3H2↑反应热;Ba(OH)2·8H2O+2NH4ClBaCl2+2NH3↑+10H2O反应热;H++OH-H2O反应热。3.写出实验21所涉及的离子反应方程式:。写出实验22所涉及的化学反应方程式:。写出实验23所涉及的离子反应方程式:。4.阅读课本P32,完成[思考与交流]。5.常见的放热反应有:;吸热反应:。课内探究一、化学反应中能量的转化1.【课本实验21】铝与盐酸的反应实验步骤眼睛看用手触用温度计测量到的现象摸的感觉的数据在一支试管中加入2~3mL6mol/L的盐酸溶液———向含有盐酸溶液的试管中插入用砂纸打磨光的铝条结论(1)铝与盐酸反应的化学方程式:。(2)在反应过程中你将能看到什么现象?(3)用眼睛不能直接观察到反应中的热量变化,你将采取哪些简单易行的办法来了解反应中的热量变化?(4)要明显地感知或测量反应中的热量变化,你在实验中应注意哪些问题?2.【课本实验22】Ba(OH)2·8H2O晶体与NH4Cl晶体的反应【注意】由于这个实验成功的关键是在短时间内反应充分进行,使体系温度快速降低,将玻璃片上的水凝固。实验中要注意三点:(1)将Ba(OH)2·8H2O晶体研磨成粉末,以便与NH4Cl晶体充分接触;(2)由于该反应属于固相反应,一定要在晶体混合后立即用玻璃棒快速搅拌混合物,以使它们很快起反应;(3)反应放出有刺激性气味的氨气,会造成学习环境的污染,所以要注意对氨气的吸收。【分组实验】阅读教材并根据已有知识设计实验步骤如下:【填写实验记录】实验步骤实验现象得出结论将晶体混合后立即用玻璃棒快速搅拌有刺激性气味的气体产生,该气体能使湿润的紫色石蕊试纸变蓝有NH3生成用手触摸烧杯下部感觉烧杯变凉反应吸热用手拿起烧杯烧杯下面的带有几滴水的玻璃片(或小木板)粘到了烧杯底部反应吸收热量使体系温度降低,使水结成冰将粘有玻璃片的烧杯放在盛有热水的烧杯上一会儿再拿起玻璃片脱离上面烧杯底部冰融化反应完后移走烧杯上的多孔塑料片,观察反应物混合物成糊状有水生成用化学方程式表示上述反应:。二、中和热的测定1.中和热的概念在稀溶液中,酸与碱反应生成所释放的热量。2.中和热的测定50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是。(2)烧杯间填满碎纸条的作用是。(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”“偏小”或“无影响”)。(4)实验中改用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由。3.思考与总结要想提高中和热测定的准确性,实验应注意什么?4.【学生分组实验23】三个学生分成一组进行实验,其中每个学生做一个实验并记录现象和数据,供组内交流、比较使用,然后讨论得出结论。最后向全班汇报,进行组间交流。【填写实验记录】反应物及用量酸HNO350mL0.5mol/LHCl50mL0.5mol/LHCl50mL0.5mol/L碱NaOH50mL0.55mol/LNaOH50mL0.55mol/LKOH50mL0.55mol/L混合前温度室温t0室温t0室温t0混合后温度t1t2t3结论HNO3与NaOH发生中和反应时放热HCl与NaOH发生中和反应时放热HCl与KOH发生中和反应时放热对实强酸与强碱发生中和反应时放出热量验进行归纳和概括【讨论分析】三个反应的化学方程式和离子方程式分别为:;;。三、人类利用能源的三个阶段1.时期。2.时期。3.时期。【例1】近年来,科学家正在探索利用铝粉作燃料的可能性,以期铝能成为石油的一种取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的()A.铝质轻,便于运输、贮存,且安全B.铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效控制C.在地球上,铝矿资源丰富D.现代电冶铝的工业技术已为铝作为新能源奠定了重要基础【例2】我国南海...