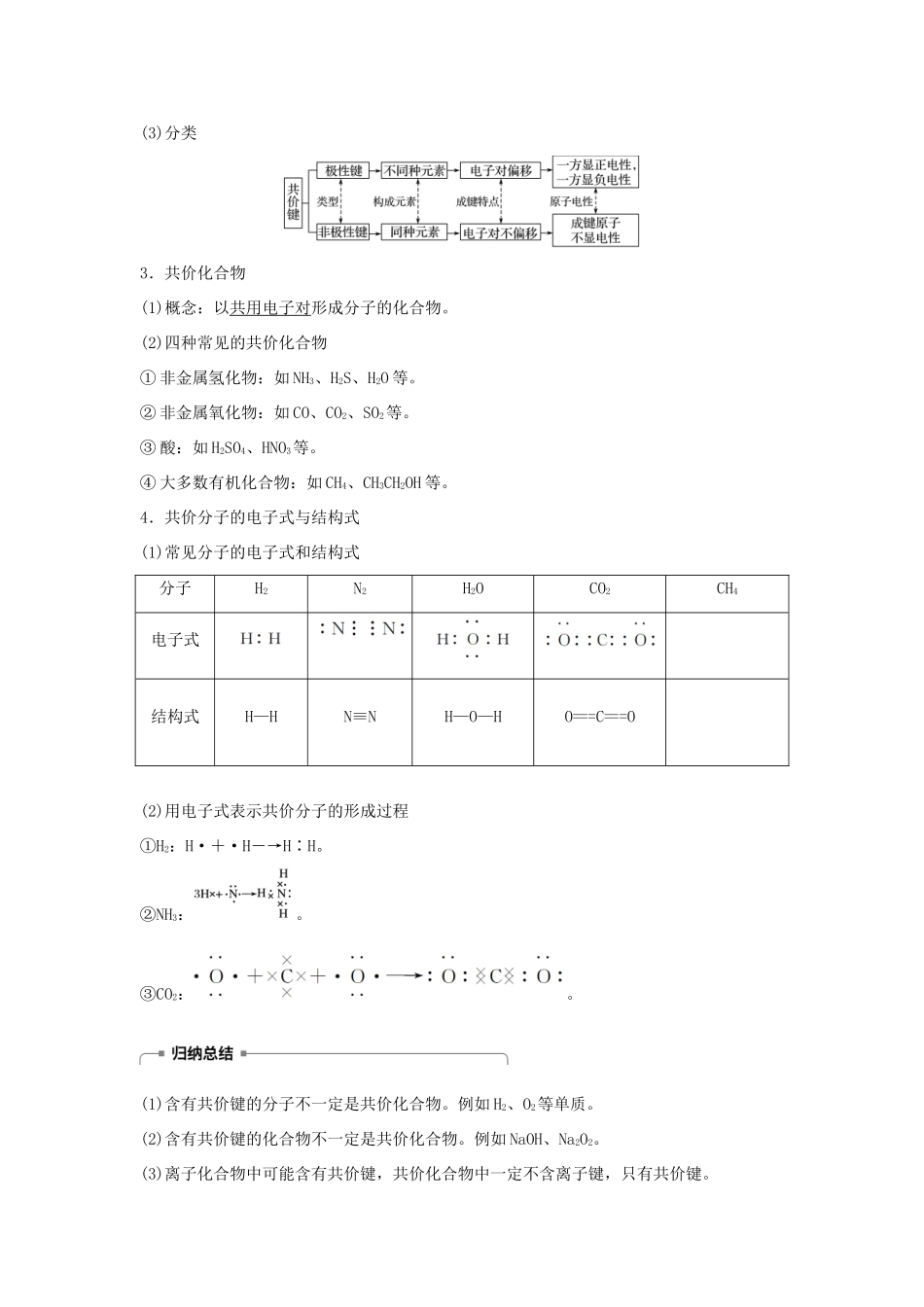
第2课时共价键分子间作用力一、共价键与共价化合物1.共价键的形成过程(1)氯分子的形成过程→→→请你根据上述图示,用电子式表示其形成过程:。(2)下图形象地表示了氯化氢分子的形成过程请你用电子式表示HCl的形成过程:。2.共价键(1)概念:原子间通过共用电子对所形成的强烈的相互作用。(2)成键三要素:①成键微粒:原子。②成键元素:一般是同种的或不同种的非金属元素。③成键条件:成键前原子最外层电子未达到饱和状态。(3)分类3.共价化合物(1)概念:以共用电子对形成分子的化合物。(2)四种常见的共价化合物①非金属氢化物:如NH3、H2S、H2O等。②非金属氧化物:如CO、CO2、SO2等。③酸:如H2SO4、HNO3等。④大多数有机化合物:如CH4、CH3CH2OH等。4.共价分子的电子式与结构式(1)常见分子的电子式和结构式分子H2N2H2OCO2CH4电子式结构式H—HN≡NH—O—HO===C===O(2)用电子式表示共价分子的形成过程①H2:H·+·H―→H∶H。②NH3:。③CO2:。(1)含有共价键的分子不一定是共价化合物。例如H2、O2等单质。(2)含有共价键的化合物不一定是共价化合物。例如NaOH、Na2O2。(3)离子化合物中可能含有共价键,共价化合物中一定不含离子键,只有共价键。例1下列叙述中,不正确的是()A.含有共价键的物质一定是共价化合物B.H2O2中既含有极性键又含有非极性键C.CaO和NaCl晶体熔化时均要破坏离子键D.H2SO4熔融态不导电考点共价键与共价化合物题点共价键与共价化合物的关系与应用答案A解析部分非金属单质如O2、N2中含有共价键,但不属于化合物;某些离子化合物如NaOH中既含有离子键又含有共价键。例2下列分子的电子式书写正确的是()A.氨气B.四氯化碳C.氮气D.二氧化碳考点共价键与共价化合物题点典型物质的电子式的书写与判断答案C二、化学键与分子间作用力1.化学键(1)化学键概念:使离子相结合或原子相结合的作用力。(2)分类(3)化学反应的本质:一个化学反应过程,本质上就是旧化学键的断裂和新化学键的形成过程。2.分子间作用力(1)概念:分子间存在一种把分子聚集在一起的作用力,叫做分子间作用力,又称范德华力。(2)主要特征:①广泛存在于分子之间;②只有分子充分接近时才有分子间的相互作用力,如固体和液体物质中;③分子间作用力远远比化学键弱;④由分子构成的物质,其熔点、沸点、溶解度等物理性质主要由分子间作用力大小决定。3.氢键(1)像H2O、NH3、HF这样的分子之间存在着一种比分子间作用力稍强的相互作用,这种作用使它们只能在较高的温度下才汽化,这种相互作用叫氢键。(2)氢键不是化学键,通常把氢键看作是一种较强的分子间作用力。氢键比化学键弱,比分子间作用力强。(3)分子间形成的氢键会使物质的熔点和沸点升高,对物质的水溶性有影响,如氨极易溶于水,主要是氨分子与水分子之间易形成氢键。化学键、分子间作用力和氢键的比较相互作用化学键分子间作用力氢键存在范围相邻原子(离子)之间分子之间某些含强极性键氢化物分子之间(如HF、H2O、NH3等)作用力大小强很弱比化学键弱,比分子间作用力强影响范围物质的物理性质及化学性质物质的物理性质物质的物理性质例3(2018·厦门外国语学校4月月考)关于化学键的下列叙述中,正确的是()①化学键只存在于分子之间②化学键只存在于相邻原子或离子之间③离子键是一种静电作用④化学键是相邻原子之间强烈的相互吸引⑤离子化合物可能含共价键⑥共价化合物可能含离子键⑦金属和非金属只能形成离子键⑧两个非金属和非金属原子间只能形成共价键A.②③④⑦B.②③⑤⑧C.②④⑤⑥D.①③⑤⑧考点化学键与化学反应的本质题点化学键与物质类型的关系答案B解析离子化合物、共价化合物等都含有化学键,分子之间存在分子间作用力,故①不正确;化学键是相邻原子或离子之间强烈的相互作用,故②正确;离子键就是阴、阳离子之间的一种静电作用,相互吸引相互排斥,故③正确;化学键是相邻原子之间强烈的相互作用,故④不正确;含有离子键的化合物是离子化合物,全部由共价键形成的化合物是共价化合物,共价化合物中一定不含离子键,所以⑤⑧正确,⑥⑦不正确。例4下列物质发生变化时,所克服的粒子相互作用属于同种类型的是()A....