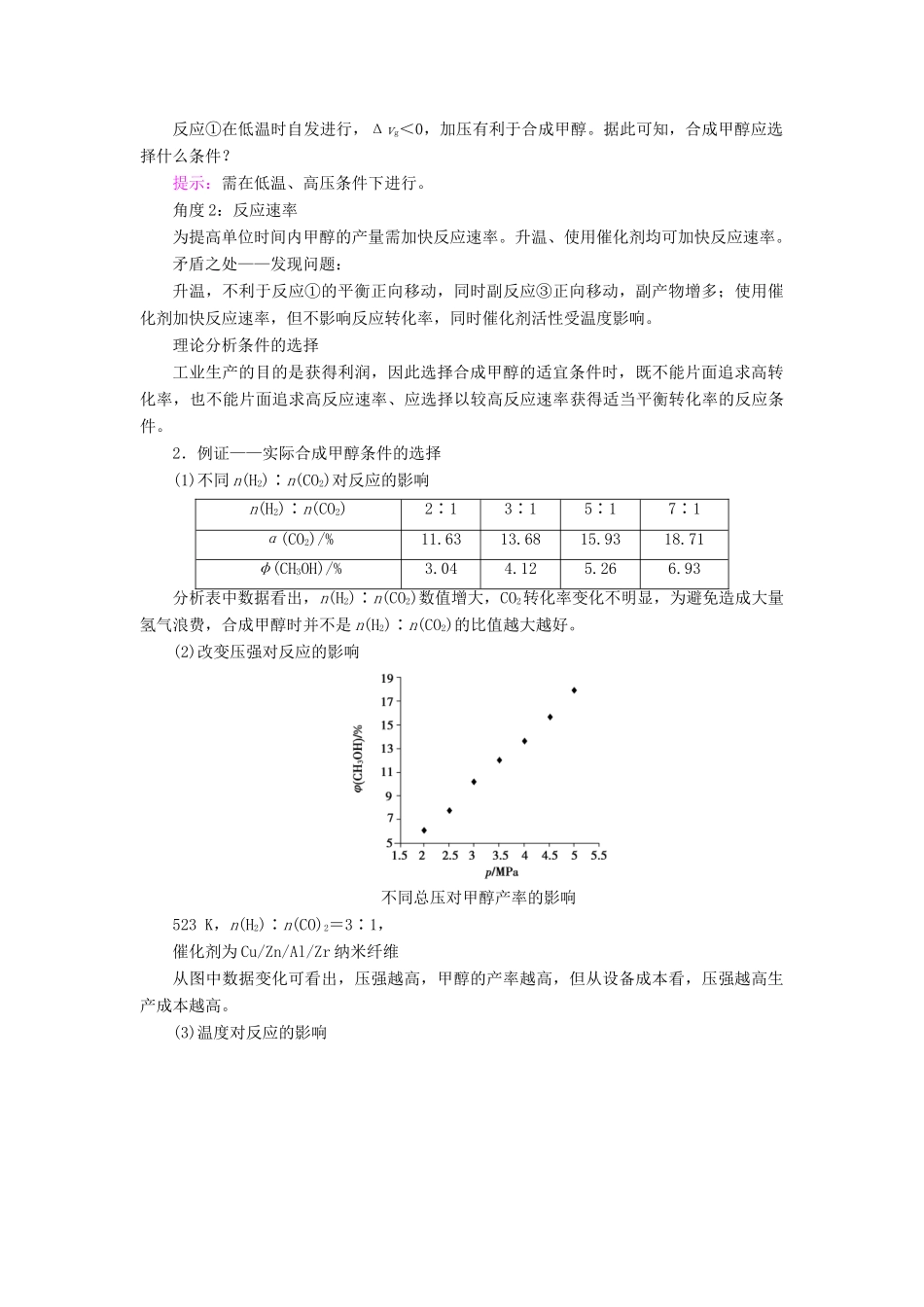
微项目探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化通过利用工业废气中的二氧化碳合成甲醇反应的选择以及对反应条件的优化,体会反应的焓变、熵变、化学平衡和速率相关知识的应用价值,形成从物质转化以及反应的方向、限度、快慢等多个角度综合分析、解决工业生产实际问题的基本思路。通过本项目的学习,树立绿色化学理念,认识到利用化学反应将无用物质转化为有用物质是解决环境问题的重要途径之一。[必备知识]1.目前有机原料按消费量排序,前4位从大到小依次是乙烯、丙烯、苯、甲醇。2.合成甲醇的原料3.选择CO2作碳源合成甲醇的原因(1)工业废气中含大量CO2,排放到空气中会带来环境问题;(2)天然气、煤、石油属于不可再生资源,日渐减少;(3)用CO2合成甲醇符合绿色化学要求。项目活动1选择合适的化学反应假设反应焓变和熵变不随温度的改变而变化,已知298K,100kPa时,有如下反应:①CO2(g)+3H2(g)===CH3OH(g)+H2O(g)ΔH=-48.97kJ·mol-1ΔS=-177.16J·mol-1·K-1②CO2(g)+2H2O(g)===CH3OH(g)+O2(g)ΔH=+676.48kJ·mol-1ΔS=-43.87J·mol-1·K-1③CO2(g)+H2(g)===CO(g)+H2O(g)ΔH=+41.17kJ·mol-1ΔS=+42.08J·mol-1·K-1[思考]1.请根据焓变和熵变复合判据判断上述三个反应是否正向自发进行?提示:反应①,ΔH-TΔS=-48.97kJ·mol-1-298K×(-0.17716)kJ·mol-1·K-1≈3.82kJ·mol-1>0,该反应属于放热熵减反应,降低温度时正向反应自发进行。反应②,ΔH-TΔS=+676.48kJ·mol-1-298K×(-0.04387)kJ·mol-1·K-1≈+689.55kJ·mol-1>0,该反应属于吸热熵减反应,在任何温度下正向反应均不自发进行。反应③,ΔH-TΔS=+41.17kJ·mol-1-298K×0.04208kJ·mol-1·K-1≈+28.63kJ·mol-1>0,该反应属于吸热熵增反应,在高温下正向反应自发进行。2.用CO2合成甲醇时发生的反应有哪些?提示:有反应①、③,其中反应③是较高温度时的副反应。项目活动2选择适宜的反应条件1.理论分析角度1:反应限度(转化率)反应①在低温时自发进行,Δvg<0,加压有利于合成甲醇。据此可知,合成甲醇应选择什么条件?提示:需在低温、高压条件下进行。角度2:反应速率为提高单位时间内甲醇的产量需加快反应速率。升温、使用催化剂均可加快反应速率。矛盾之处——发现问题:升温,不利于反应①的平衡正向移动,同时副反应③正向移动,副产物增多;使用催化剂加快反应速率,但不影响反应转化率,同时催化剂活性受温度影响。理论分析条件的选择工业生产的目的是获得利润,因此选择合成甲醇的适宜条件时,既不能片面追求高转化率,也不能片面追求高反应速率、应选择以较高反应速率获得适当平衡转化率的反应条件。2.例证——实际合成甲醇条件的选择(1)不同n(H2)∶n(CO2)对反应的影响n(H2)∶n(CO2)2∶13∶15∶17∶1α(CO2)/%11.6313.6815.9318.71φ(CH3OH)/%3.044.125.266.93分析表中数据看出,n(H2)∶n(CO2)数值增大,CO2转化率变化不明显,为避免造成大量氢气浪费,合成甲醇时并不是n(H2)∶n(CO2)的比值越大越好。(2)改变压强对反应的影响不同总压对甲醇产率的影响523K,n(H2)∶n(CO)2=3∶1,催化剂为Cu/Zn/Al/Zr纳米纤维从图中数据变化可看出,压强越高,甲醇的产率越高,但从设备成本看,压强越高生产成本越高。(3)温度对反应的影响不同温度对甲醇产率的影响总压5MPa,n(H2)∶n(CO2)=3∶1,催化剂为Cu/Zn/Al/Zr纳米纤维从图中信息看出温度过高后甲醇产率下降。[思考]1.从以上(1)、(2)、(3)的分析,合成甲醇的适宜条件应如何选择?提示:应选择合适的n(H2)∶n(CO2)、较高的总压强、适宜的温度和催化剂有利于合成甲醇。2.从工业生产流程考虑还有哪些手段可提高甲醇的产率?提示:配置二氧化碳富集装置、甲醇—水分离装置以及副产物一氧化碳回收装置等。设计化学反应来解决实际问题的一般思路在生产和科研实际中,我们常常需要设计新的反应路线或设计试制新的化学品。这时,首先需要判断所设计反应是否可行,即判断在某种条件下所设计反应是否能够正向自发进行、能进行到什么程度。只有在确知所设计反应可以...