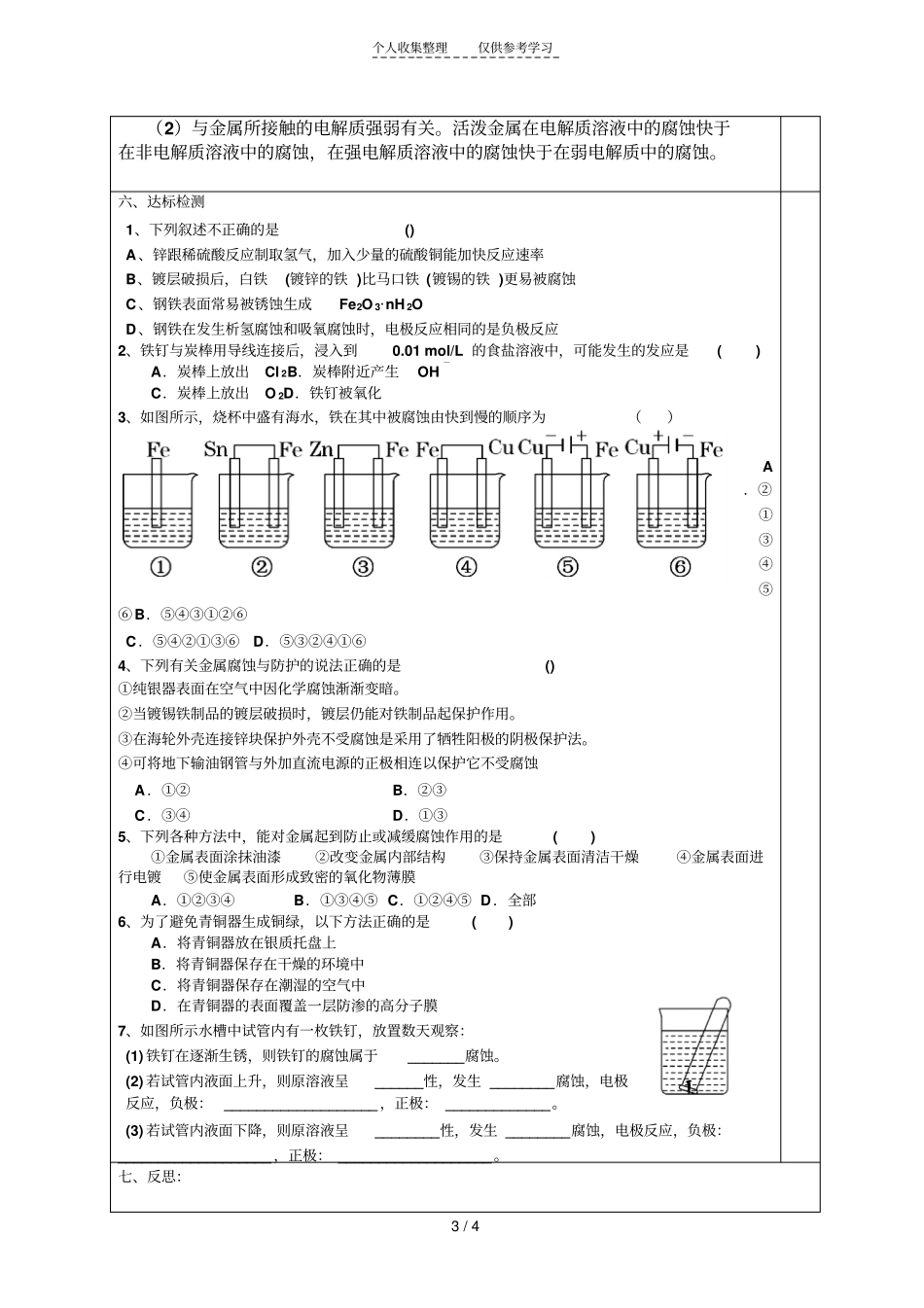
个人收集整理仅供参考学习1/4化学选修4导学案课题金属的电化学腐蚀与防护节次第1课时学习目标1、了解金属腐蚀的种类,探究金属发生电化学腐蚀的原因2、掌握化学腐蚀和电化学腐蚀的区别学习重点吸氧腐蚀、析氢腐蚀的原理学习难点吸氧腐蚀、析氢腐蚀的原理学习程序学习笔记知识链接钢铁及其制品通常为含碳的铁合金,若在潮湿的环境里或湿度较大的环境里长期放置,常易生锈变红,为什么呢?学习新知一、金属腐蚀的本质1、金属腐蚀的本质:【问题讨论1】我们通常使用的金属是纯金属么?成分如何?【问题讨论2】你了解铁锈、铜锈的主要成分么?【问题探究3】用氧化还原的观点看,金属腐蚀的本质是什么?2、铁钉腐蚀条件的探究现有洁净无锈的铁钉,试管、植物油、NaCl溶液、CH3COOH溶液和煮沸后迅速冷却的蒸馏水、无水氯化钙、棉花,你也可以选用其他物品,设计实验探究铁钉锈蚀需要哪些条件,以及在什么条件下锈蚀速率快。编号①②③④⑤实验方案煮沸后迅速冷却的蒸馏水且加植物油+铁钉棉花+干燥剂氯化钙+铁钉且盖上塞子蒸馏水+铁钉NaCl溶液+铁钉醋酸溶液+铁钉记录结论二、金属腐蚀的分类1、化学腐蚀:【问题讨论1】Fe在Cl2条件下反应?铁是否被腐蚀?Mg在O2中燃烧,Mg是否被腐蚀?【问题讨论2】化学腐蚀受什么因素影响较大?2、电化学腐蚀的原理请同学们阅读教材P84~P85完成电化学腐蚀的原理。析氢腐蚀吸氧腐蚀条件水膜呈水膜呈请把预习过程中产生的疑问记录下来个人收集整理仅供参考学习2/4电极反应负极(Fe极)正极(C极)总反应联系金属的腐蚀以电化腐蚀为主,电化腐蚀又以吸氧腐蚀为主。3、化学腐蚀与电化腐蚀的比较:化学腐蚀电化腐蚀发生的条件现象本质联系电化学腐蚀比化学腐蚀要普遍得多,腐蚀速度也快很多三、金属的电化学保护【问题讨论】鉴于金属发生腐蚀的原因,我们可以从哪些方面设想解决问题的思路?1、隔离法:①喷涂漆;②涂油脂;③表面钝化;④电镀(铬等耐腐蚀性较强的金属镀层)2、加入其他金属改变其结构3、牺牲阳极的阴极保护法原理:形成原电池反应时,让被保护金属做极,不反应,起到保护作用;而活泼金属反应受到腐蚀。4、外加电流的阴极保护法原理:将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。四、小结五、(扩展)判断金属腐蚀快慢的规律不纯的金属或合金,在潮湿的空气中形成原电池发生电化学腐蚀,活泼金属因被腐蚀而耗损。金属的腐蚀的快慢与下列两种因素有关:(1)与构成原电池的材料有关。两级材料的活动性差别越大,氧化还原反应的速率越快,活泼金属被腐蚀的速率越快。危害:损失金属材料,损失设备本质:M-ne-=Mn+氧化反应金属的腐蚀特征:伴有电流电化学腐蚀析氢腐蚀吸氧腐蚀(主)化学腐蚀地位:次要特征:无电流产生地位:主要类型及危害类型金属的防护本质:阻止M-ne-=Mn+的发生方法应用电化学保护其他牺牲阳极的阴极保护法外加电流的阴极保护法改变金属的内部结构在金属表面盖保护层个人收集整理仅供参考学习3/4(2)与金属所接触的电解质强弱有关。活泼金属在电解质溶液中的腐蚀快于在非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀快于在弱电解质中的腐蚀。六、达标检测1、下列叙述不正确的是()A、锌跟稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率B、镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀C、钢铁表面常易被锈蚀生成Fe2O3·nH2OD、钢铁在发生析氢腐蚀和吸氧腐蚀时,电极反应相同的是负极反应2、铁钉与炭棒用导线连接后,浸入到0.01mol/L的食盐溶液中,可能发生的发应是()A.炭棒上放出Cl2B.炭棒附近产生OH-C.炭棒上放出O2D.铁钉被氧化3、如图所示,烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为()A.②①③④⑤⑥B.⑤④③①②⑥C.⑤④②①③⑥D.⑤③②④①⑥4、下列有关金属腐蚀与防护的说法正确的是()①纯银器表面在空气中因化学腐蚀渐渐变暗。②当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用。③在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法。④可...