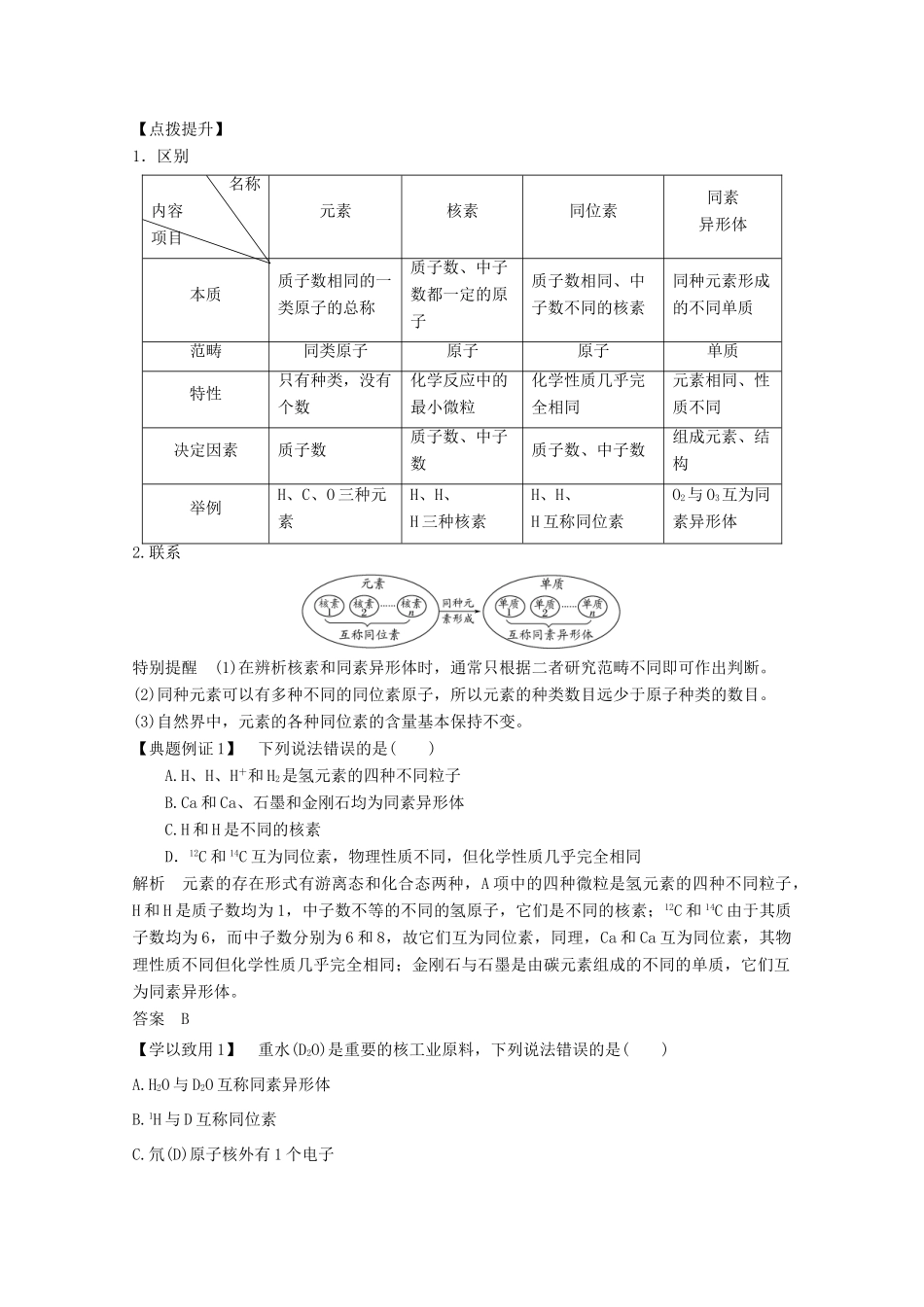
第3课时核素学习目标核心素养建构1.了解质量数的定义。2.了解原子的表示方法。3.了解核素和同位素的概念。4.能识别不同概念间的相互关系。[知识梳理]一、原子构成、质量数1.原子的构成(1)构成原子(2)原子的表示方法\s\up7(质量数←A)→元素符号,如Cl表示质量数为37、核电荷数为17的氯原子。2.质量数(1)质量数质子和中子的相对质量都近似为1,忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加所得的数值即为质量数,用符号A表示。(2)两个关系①质量数(A)=质子数(Z)+中子数(N)(质量关系)。②原子序数=核电荷数=质子数=核外电子数(数量关系)。二、核素、同位素1.核素(1)定义:具有一定数目质子和一定数目中子的一种原子。(2)氢的三种核素原子符号(X)原子名称氢元素的原子核质子数(Z)中子数(N)H氕10H或D氘11H或T氚12【自主思考】1.所有原子的原子核内都有质子和中子吗?提示不一定。原子核中一定含有质子,但不一定有中子,如H中只有质子没有中子。2.同位素(1)定义:质子数相同而中子数不同的同一元素的不同原子互称为同位素,即同一元素的不同核素互称为同位素;如H、H(D)、H(T)之间互称为同位素。(2)特点:天然存在的同位素,相互间保持一定的比率。(3)几种重要核素的用途:6C在考古工作中用于测定文物的年代;U用于制造原子弹、核发电;H、H用于制造氢弹;放射性同位素释放的射线用于育种、治疗肿瘤等。【自主思考】2.质子数相同而中子数不同的微粒一定互为同位素吗?提示同位素是质子数相同而中子数不同的同一元素的不同原子,而微粒包括原子、分子、离子等,如NH和Na+都有11个质子,显然不能称为同位素。[效果自测]1.判断正误,正确的打“√”,错误的打“×”。(1)所有原子都由质子、中子和核外电子构成()(2)原子的种类大于元素的种类()(3)某种氯原子的中子数是18,则其质量数是35,核外电子数是17()(4)不同元素的核素的质量数一定不同()(5)C和N互为同位素()(6)U与U是同一种核素()(7)14C可用于文物的年代鉴定,14C与12C为同种单质()答案(1)×(2)√(3)√(4)×(5)×(6)×(7)×2.下列8种化学符号:H2、H2、C、Li、Na、N、Li、Mg。(1)表示核素的符号共________种。(2)互为同位素的是________和________。(3)中子数相等,但质子数不相等的核素是________和__________。解析(1)H2、H2为分子不属于核素范畴。(2)Li、Li的质子数相同,中子数不同,二者互为同位素。(3)Na和Mg的中子数相等,但质子数不同。答案(1)6(2)LiLi(3)NaMg探究一、元素、核素、同位素、同素异形体的区别和联系【合作交流】1.质子数相同的微粒一定属于同一种元素吗?提示微粒的种类包括分子、原子、离子、质子、中子、电子等,而质子数相同的原子才属于同一种元素,质子数相同的微粒(如Ne和H2O都含有10个质子)不一定属于同一种元素。2.一种元素可以有多种核素,决定核素的微粒是什么?如何判断不同核素是否属于同位素?提示核电荷数(质子数)决定了元素,只有确定了质子数和中子数才能确定核素;同位素属于同种元素,其质子数一定相同,故不同核素中,质子数相同的核素属于同位素。3.同位素在周期表中位于同一位置,那么在周期表中位于同一位置的元素一定为同位素吗?提示不一定。因为同位素的质子数(原子序数)相同,所以在周期表中位于同一位置;但在周期表中位于同一位置的镧系和锕系元素,因其质子数不同,不属于同种元素,不属于同位素。4.16O与18O互为同位素,O2与O3互为同素异形体,同位素与同素异形体有什么区别?提示(1)意义不同,同位素是指质子数相同而中子数不同的同一元素的不同原子之间的互称;而同素异形体是指同一元素形成的不同单质。(2)所指对象不同,同位素指的是原子,而同素异形体指的是单质。【点拨提升】1.区别名称内容项目元素核素同位素同素异形体本质质子数相同的一类原子的总称质子数、中子数都一定的原子质子数相同、中子数不同的核素同种元素形成的不同单质范畴同类原子原子原子单质特性只有种类,没有个数化学反应中的最小微粒化学性质几乎完全相同元素相同、性质不同决定因素质子数质子数、中子数质子数、中子数组成元素、结构举例H、C、O...