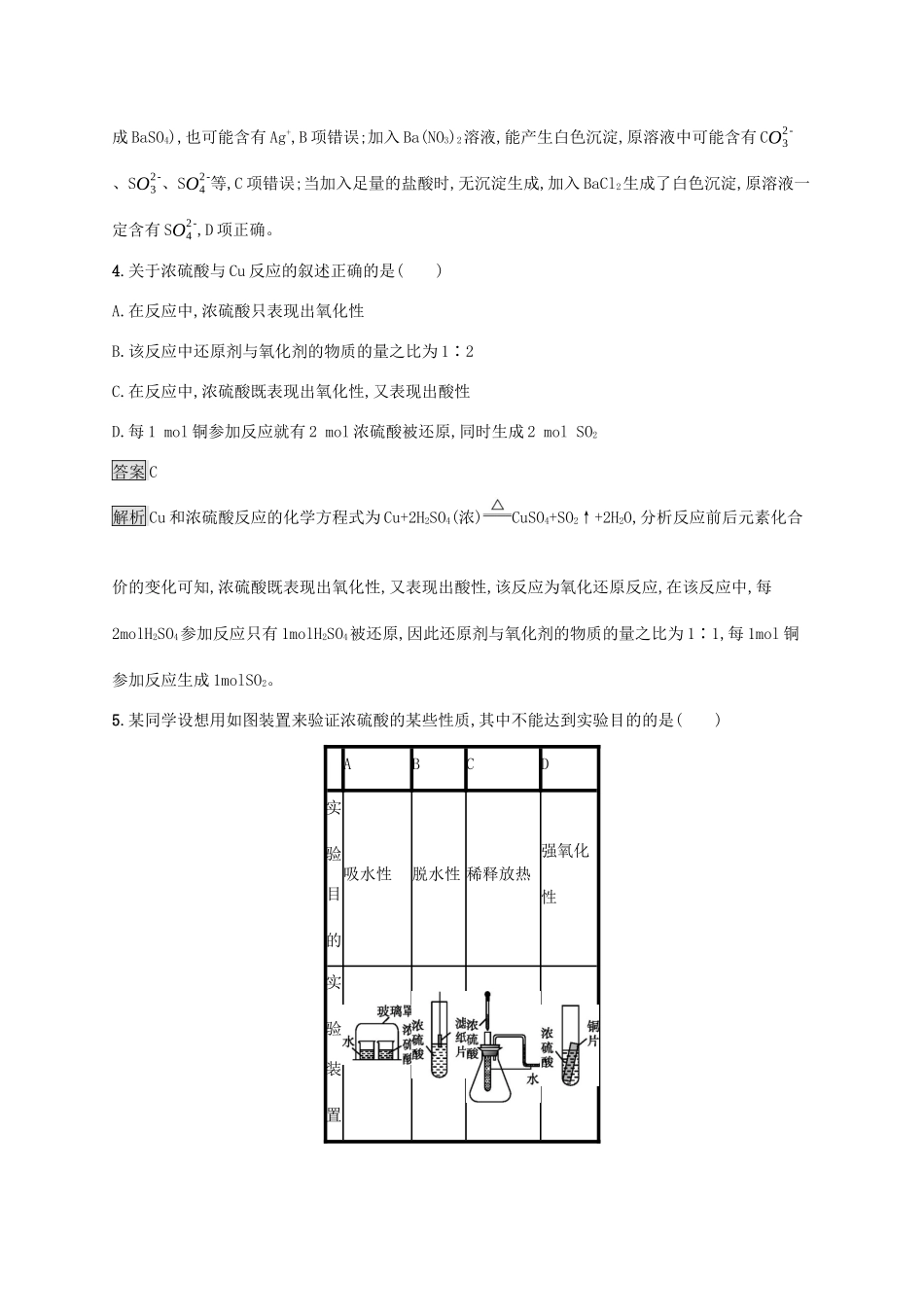
第2课时硫酸酸雨及其防治课后篇巩固提升夯实基础·轻松达标1.下列气体不能用浓硫酸干燥的是()A.H2B.SO2C.NH3D.Cl2答案C解析浓硫酸具有酸性,氨气是碱性气体,不能用浓硫酸干燥,应该用碱石灰干燥。2.某雨水样品刚采集时测得pH为4.8,放在烧杯中经2小时后,再次测得pH为4.0。以下叙述正确的是()A.该雨水样品不属于酸雨B.该雨水样品酸性没有变化C.该雨水样品pH降低的原因可能是继续吸收空气中的CO2D.该雨水样品中的pH降低的原因可能是H2SO3逐渐被氧气氧化成H2SO4答案D解析题中雨水的pH小于5.6,属于酸雨,A项错误;溶液的pH越小,酸性越强;故某雨水样品刚采集时测得pH为4.8,放在烧杯中经2小时后,再次测得pH为4.0,雨水样品酸性逐渐增强,B项错误;可能是雨水样品中的H2SO3逐渐被空气中的氧气氧化成H2SO4,导致雨水的酸性增强,而不应该是继续吸收空气中的CO2导致,C项错误,D项正确。3.比较下述实验方案,能判断溶液中一定含有SO42-的事实是()A.取少量试样溶液,加入用盐酸酸化的BaCl2溶液,有白色沉淀生成B.取试样溶液,加入BaCl2溶液,有白色沉淀,再加稀硝酸,沉淀不溶解C.取少量试样溶液,加入Ba(NO3)2溶液,有白色沉淀生成D.取少量试样溶液,加入足量盐酸,无沉淀产生,再加入BaCl2溶液,有白色沉淀生成答案D解析加盐酸酸化的BaCl2溶液有白色沉淀生成时,原溶液可能含有Ag+或SO42-,A项错误;加入BaCl2溶液有白色沉淀生成,再加稀硝酸,沉淀不溶解,原溶液中可能含有SO42-或SO32-(BaSO3能被HNO3氧化成BaSO4),也可能含有Ag+,B项错误;加入Ba(NO3)2溶液,能产生白色沉淀,原溶液中可能含有CO32-、SO32-、SO42-等,C项错误;当加入足量的盐酸时,无沉淀生成,加入BaCl2生成了白色沉淀,原溶液一定含有SO42-,D项正确。4.关于浓硫酸与Cu反应的叙述正确的是()A.在反应中,浓硫酸只表现出氧化性B.该反应中还原剂与氧化剂的物质的量之比为1∶2C.在反应中,浓硫酸既表现出氧化性,又表现出酸性D.每1mol铜参加反应就有2mol浓硫酸被还原,同时生成2molSO2答案C解析Cu和浓硫酸反应的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,分析反应前后元素化合价的变化可知,浓硫酸既表现出氧化性,又表现出酸性,该反应为氧化还原反应,在该反应中,每2molH2SO4参加反应只有1molH2SO4被还原,因此还原剂与氧化剂的物质的量之比为1∶1,每1mol铜参加反应生成1molSO2。5.某同学设想用如图装置来验证浓硫酸的某些性质,其中不能达到实验目的的是()ABCD实验目的吸水性脱水性稀释放热强氧化性实验装置答案D解析A项中由于分子是在不断运动的,故玻璃罩内空气中的水蒸气不断地被浓硫酸吸收,导致左侧烧杯中的水不断挥发,最后左侧烧杯内的液体量明显少于右侧烧杯内的液体量,能达到实验目的;B项中滤纸接触浓硫酸后,很快会因脱水而变黑,能达到实验目的;C项中浓硫酸滴到小试管内的水中,放出的热量会使锥形瓶内气压增大,U形管内液面出现左低右高的现象,能达到实验目的;D项中因常温下铜片与浓硫酸不反应,无法判断浓硫酸是否表现出强氧化性,不能达到实验目的。6.下列有关说法中正确的是()A.浓硫酸在常温下能够使铁、铝等金属钝化,因此浓硫酸在常温下不能与铁、铝发生反应B.白纸上滴加浓硫酸后变黑体现了浓硫酸的吸水性C.浓硫酸主要以H2SO4分子存在D.稀硫酸和浓硫酸性质完全相同答案C解析浓硫酸在常温下能够使铁、铝等金属钝化发生了化学反应;浓硫酸主要以H2SO4分子存在,而稀硫酸中以H+和SO42-存在,二者性质不同。7.已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)CuSO4+A↑+2H2O。试通过计算和推理完成下面的空白:(1)A物质可以导致酸雨的形成。A应该属于(用字母代号填写)。a.酸b.碱c.盐d.酸性氧化物e.碱性氧化物(2)A物质可以使酸性KMnO4溶液褪色,此反应中(填写化学式,下同)失去电子,氧化剂是。(3)足量的铜片与10mL18mol·L-1的浓硫酸充分反应,如果该反应过程中转移了0.1mol电子,生成的CuSO4的物质的量为mol,生成的A气体在标准状况下体积为L(假设气体全部逸出)。(4)计算:将反应后得到的溶液与足量Ba(OH)2溶液混合,充分反应。反应后所得沉淀的质量为g。答案(1)d(2)SO2KMnO4(3)0.051.12(4)35.19解析已知铜和浓硫酸可以在加热条件下发生反应:Cu+2H2SO...