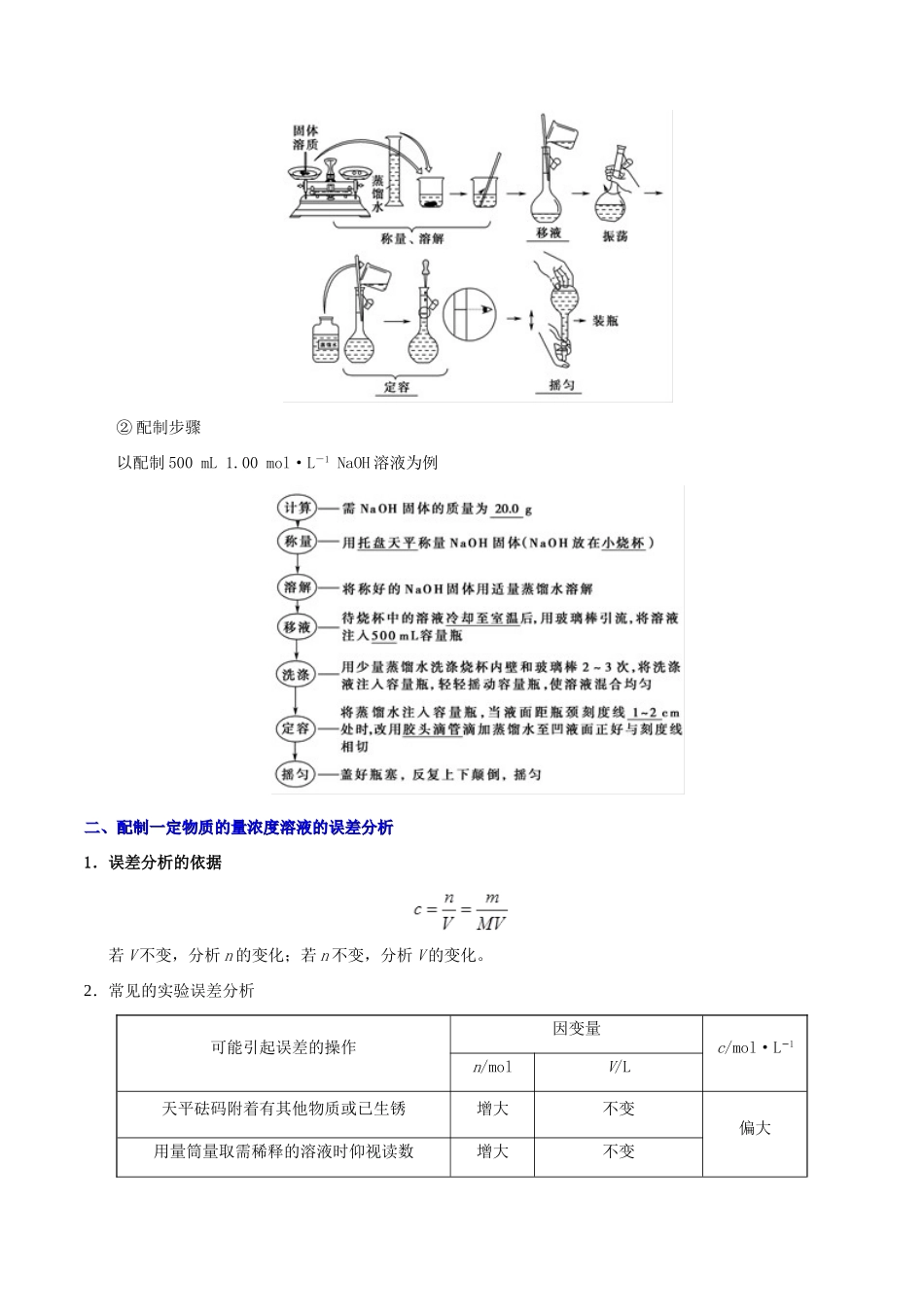
考点03物质的量浓度及溶液的配制一、一、物质的量浓度物质的量浓度1.物质的量浓度定义用来表示单位体积溶液里所含溶质B的物质的量的物理量,叫做溶质B的物质的量浓度,符号为cB,单位为mol/L(或mol·L1−)。2.物质的量(nB)、物质的量浓度(cB)与溶液体积(V)之间的关系物质的量浓度(cB)=,即。(1)溶质是溶液中的溶质,可以指化合物,也可以指离子或其他特殊的组合。分析溶质时要注意特殊情况下的溶液的溶质,如NH3溶于水后所得氨水的溶质为NH3·H2O,但习惯上认为氨水的溶质为NH3;SO3溶于水后所得溶液的溶质为H2SO4;CuSO4·5H2O溶于水后所得溶液的溶质为CuSO4。(2)体积V指溶液的体积而不是溶剂的体积。3.一定物质的量浓度溶液的配制(1)溶液配制过程中五种仪器的使用仪器注意事项或作用容量瓶(1)不能将固体或浓溶液直接在容量瓶中溶解或稀释(2)不能作为反应器或用来长期贮存溶液(3)不能将过冷或过热的溶液转移到容量瓶中,因为容量瓶的容积是在瓶身所标温度下确定的(4)不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液①构造及用途②查漏操作量筒(1)不能作反应器(2)不能将浓溶液直接在量筒中稀释(3)量取的液体倒出后不必洗涤托盘天平(1)使用前调零(2)药品不能直接放在托盘上(3)左物右码,先大后小(4)读数至小数点后1位玻璃棒(1)在溶液配制中的作用是搅拌、引流(2)搅拌勿碰烧杯内壁,引流注意玻璃棒下端应在刻度线以下烧杯(1)用于溶解固体或稀释浓溶液(2)将溶液转入容量瓶后,必须将烧杯洗涤2~3次,洗涤液转入容量瓶注意:①熟知常见量器的精确度:量筒精确到0.1mL,滴定管精确到0.01mL,广泛pH试纸精确到整数值。②选择容量瓶时遵循“大而近”的原则,所需溶质的量按所选用的容量瓶的规格进行计算。③不能将固体或浓溶液直接在容量瓶中溶解或稀释。④向容量瓶中注入液体时,要用玻璃棒引流;且玻璃棒下端要靠在容量瓶的刻度线以下的瓶颈壁上。(2)配制步骤①过程示意图②配制步骤以配制500mL1.00mol·L-1NaOH溶液为例二、配制一定物质的量浓度溶液的误差分析二、配制一定物质的量浓度溶液的误差分析1.误差分析的依据若V不变,分析n的变化;若n不变,分析V的变化。2.常见的实验误差分析可能引起误差的操作因变量c/mol·L1−n/molV/L天平砝码附着有其他物质或已生锈增大不变偏大用量筒量取需稀释的溶液时仰视读数增大不变定容时俯视容量瓶刻度线不变减小溶液未冷却就转入容量瓶进行定容不变减小砝码残缺减小不变偏小药品和砝码位置颠倒(使用游码)减小不变没有洗涤烧杯减小不变定容时仰视容量瓶刻度线不变增大溶质已潮解或含有其他杂质减小不变定容摇匀后又加蒸馏水不变增大用量筒量取需稀释的溶液时俯视读数减小不变定容时蒸馏水加多后用吸管吸出减小不变转移时有少量液体洒在容量瓶外减小不变图1使所配溶液体积偏大,浓度偏小;图2使所配溶液体积偏小,浓度偏大。三、物质的量浓度的计算方法三、物质的量浓度的计算方法(1)有关溶液混合稀释的计算①不同物质的量浓度溶液的混合。稀释:抓住稀释前后溶质的物质的量不变,列方程式:c1·V1=c2·V2a.如果忽略溶液体积变化,则c1·V1+c2·V2=c混·(V1+V2)b.如果考虑溶液混合后的体积改变,则c1·V1+c2·V2=c混·V混(V混=)②不同质量分数的两种溶液混合的计算。混合:抓住混合前后溶质的质量不变,列方程式:m1·ω1+m2·ω2=(m1+m2)·ω混③两种同溶质溶液等质量混合、等体积混合时质量分数的判定。a.等质量混合:两种同溶质液体(或某溶液与水)等质量混合时,ω混=。b.等体积混合:两种同溶质液体(或某溶液与水)等体积混合时,当ρ液>1时,ω混>。当ρ液<1时,ω混<。(2)物质的量浓度、溶解度、质量分数的相互换算①溶质的质量分数ω与物质的量浓度c:c====(密度的单位为g·cm3−或g·mL1−)②饱和溶液溶质的质量分数与溶解度:ω=×100%,c=③标准状况下气体溶解于水后所得溶液的物质的量浓度c=式中V为标准状况下气体的体积(单位为L),V(H2O)为水的体积(单位为L,ρ水=1g·mL1−),ρ为溶液的密度(单位为g·cm3−或g·mL1−),M为气体摩尔质量(单...