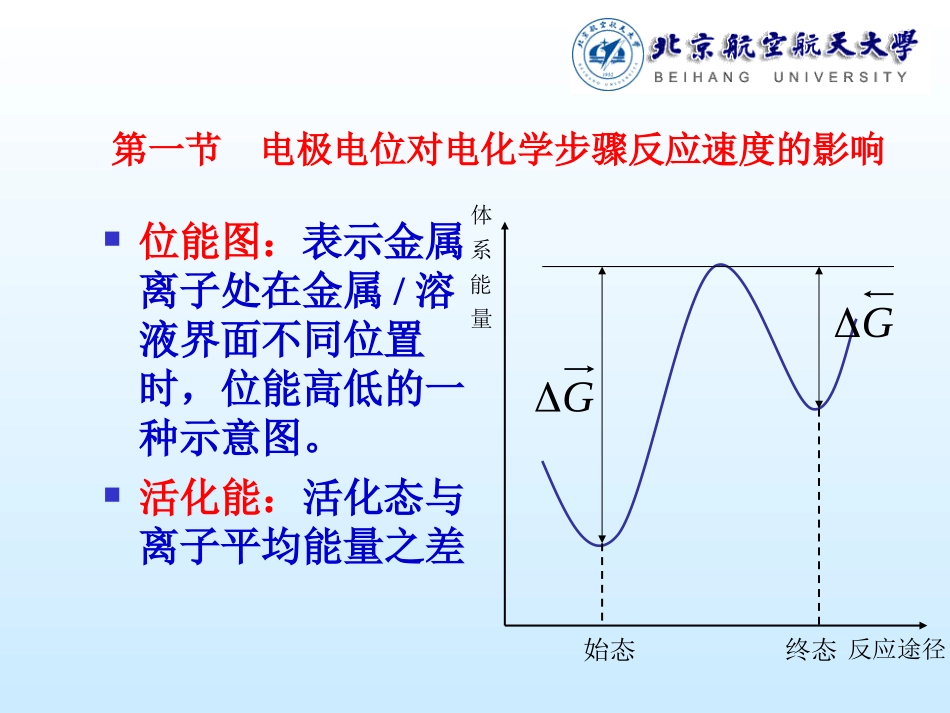
第六章电子转移步骤动力学重点要求稳态电化学极化规律电子转移步骤的基本动力学参数及其稳态测量原理双电层结构对电子转移步骤的影响电化学极化与浓差极化共存时的动力学规律第一节电极电位对电化学步骤反应速度的影响位能图:表示金属离子处在金属/溶液界面不同位置时,位能高低的一种示意图。活化能:活化态与离子平均能量之差量能系体反应途径终态始态GG一.电极反应的位能图以单电子反应为例,做如下假设:反应在紧密层进行;将反应看作在界面的转移;无特性吸附;反应离子浓度足够大。AgAgeAg:脱水化膜自溶液逸出时的位能变化;:自晶格中逸出的位能变化;:在相间转移的位能曲线;RO*R*OA0G0Gxd,OOAg,RRAgRAOAg界面电场对活化能的影响0G0GxxGGdFFFnFGG0nFGG01传递系数二.电极电位对电化学反应速度的影响设:电化学反应步骤为控制步骤,此时由化学动力学知:根据Frarday定律得:0isiccRTGkcvexpRTGcknFiOexpRTGcknFiRexp传质处于准平衡态将代入,得:其中:nFGG0nFGG0RTnFcKnFRTnFGcknFiOOexpexp0RTnFcKnFiRexpRTGkK0expRTGkK0exp令:则:将上式取对数整理后:ROcKnFicKnFi00RTnFiiRTnFiiexpexp00inFRTinFRTlog3.2log3.20inFRTinFRTlog3.2log3.20平oilog0logiilogilogilognFRT3.2斜率=对速度的影响电极电位对电极反应绝第二节电子转移步骤的基本动力学参数一.电极过程的传递系数、物理意义:表示电极电位对还原反应和氧化反应活化能影响的程度。注:单电子转移步骤中所以又称为对称系数。nFGG0nFGG05.0二.交换电流密度物理意义:平衡电位下氧化反应和还原反应的绝对速度。0expiRTnFcKnFiO平0expiRTnFcKnFiR平影响大小的因素与反应速度常数有关与电极材料有关与反应物质浓度有关与温度有关0i电化学反应动力学特性与的关系1.描述平衡状态下的动力学特征由于单电子反应0i0iiiRTFcKFRTnFcKFRO平平expexp1ROccFRTKKFRTlnln=平∴2.用表示电化学反应速度由:且得:0iRTFiiRTFiiexpexp005.01RTFRTFiiiiexpexp0=净3.用描述电化学过程进行的难易程度在一定的过电位下:定义:电极过程恢复平衡态的能力或去极化作用的能力为电极反应过程的可逆性。0i大0i大净i电极反应易进行小0i小净i电极反应难进行三.(标准)电极反应速度常数的导出:由知:当时,在平衡电位下:KKROccnFRTln,0=平ROcc,0=平,0.0,0expexpRTFcKFRTFcKFRO 令:的物理意义:标准电极电位和反应物浓度为单位浓度时的电极反应绝对速度。KROcc.0,0expexpRTFKRTFKK的应用:以代替描述动力学特征,将不包含浓度的影响:KK0iic,0expRTFFKciO,0expRTFFKciR第三节稳态电化学极化规律一.电化学极化的基本实验规律Tafel经验公式:线性关系:ibalog0ii=二.电化学极化公式1.公式的导出稳态时:净控=iiiiii=净RTFRTFiiiiexpexp0=∴巴特勒-伏尔摩方程阴极反应速度:阳极反应速度:cccRTFRTFiiiiexpexp0=aaaRTFRTFiiiiexpexp0=电化学极化曲线cjaj0j0jcajj...