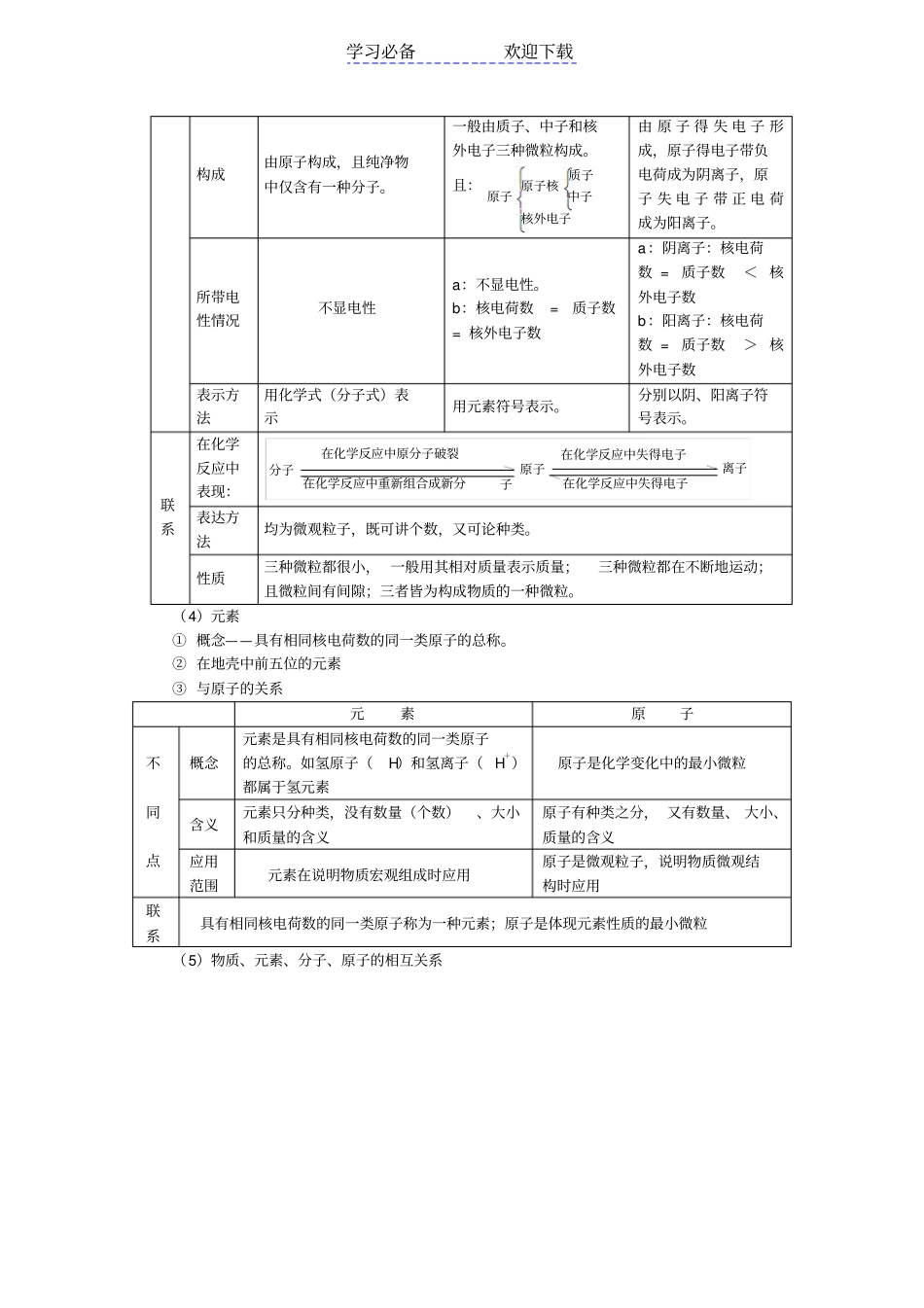
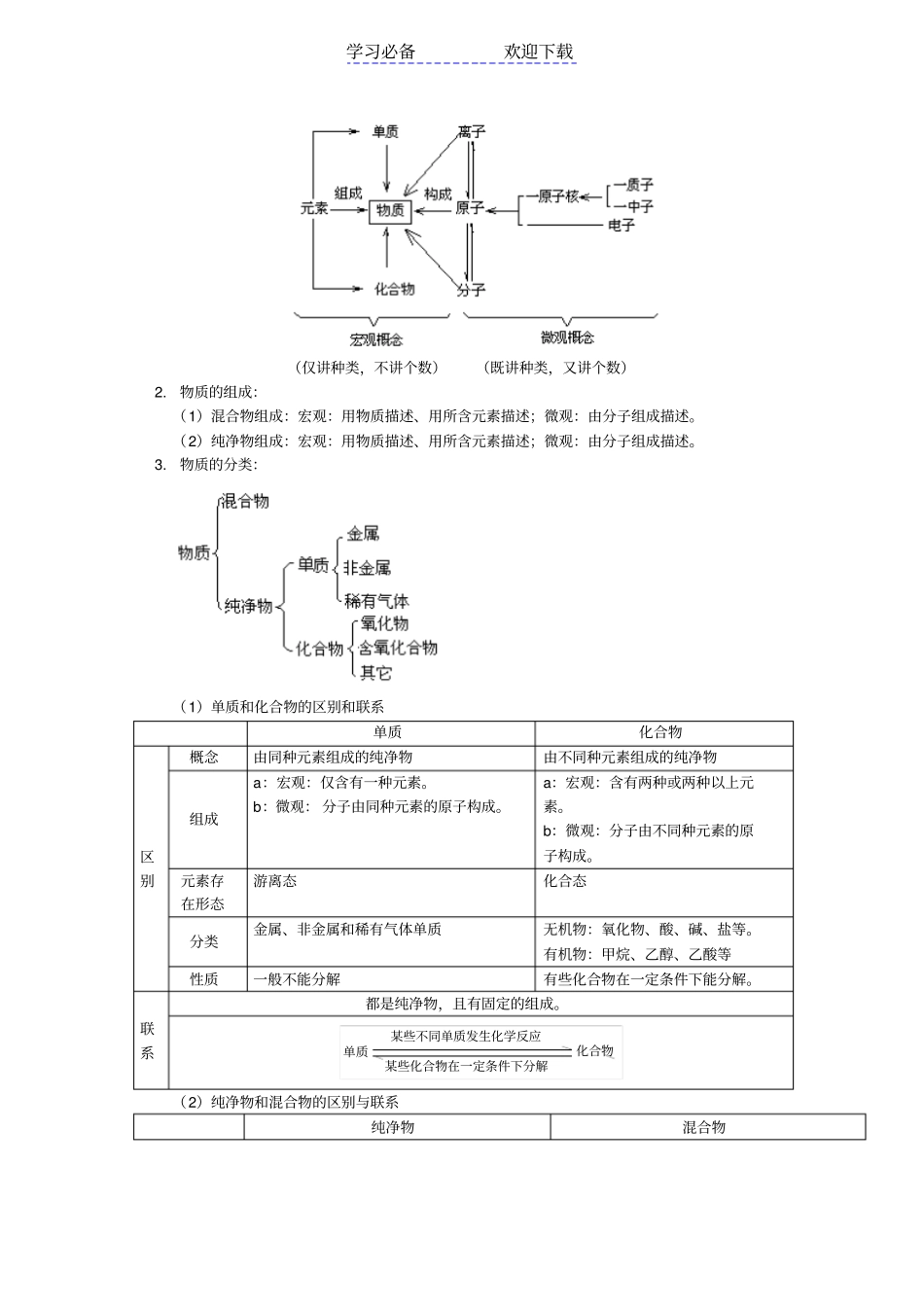
学习必备欢迎下载专题复习—分子和原子、元素、物质分类一.内容分子和原子、元素、物质分类二.重点、难点1.掌握分子、原子、元素等化学用语的概念及其异同点。2.了解物质的组成及分类的原则,从宏观、微观角度对物质组成进行描述。3.熟悉化学式的书写原则,熟练掌握有关化学式的写法及简单计算。三.知识要点1.物质的结构:(1)原子①概念——原子是化学变化中的最小微粒。②结构原子尽管很小,用化学方法不能再分,但用其它方法可以再分,因为原子也有一定的构成。的空间内做这高速运动—在核外一个相对很大—一个单位负电荷)核外电子(每个电子带积的十万分之一体积很小,约占原子体中子(不带电)单位正电荷)质子(每个质子带一个原子核(带正电)原子③各种关系a.核电荷数=核内质子数=核外电子数所以整个原子不显电性b.质子数不一定等于中子数,它们之间没有必然联系c.某原子的相对原子质量该原子的一个原子的实际质量个碳原子的实际质量112112(2)分子①概念——分子是保持物质化学性质的最小粒子。②与原子的关系(3)离子①概念——带电的原子或原子团。②与原子的关系分子原子离子区别定义保持物质化学性质的一种微粒是化学变化中的最小微粒。带电的原子或原子团。化学变化中是否可分在化学变化中可分,变化前后种类和数目可能发生变化。在化学变化中不可分,变化前后种类和数目不发生变化。在化学变化中,单原子离子一般不可分,但原子团构成的离子可能分割成其它离子、原子或分子。是否独立存在能独立存在,构成物质并保持物质的化学性质不变有些能独立存在,并直接构成物质,且能保持物质的化学性质不变。阴、阳离子共同构成物质,形成离子化合物。学习必备欢迎下载构成由原子构成,且纯净物中仅含有一种分子。一般由质子、中子和核外电子三种微粒构成。且:核外电子中子质子原子核原子由原子得失电子形成,原子得电子带负电荷成为阴离子,原子失电子带正电荷成为阳离子。所带电性情况不显电性a:不显电性。b:核电荷数=质子数=核外电子数a:阴离子:核电荷数=质子数<核外电子数b:阳离子:核电荷数=质子数>核外电子数表示方法用化学式(分子式)表示用元素符号表示。分别以阴、阳离子符号表示。联系在化学反应中表现:在化学反应中原分子破裂在化学反应中重新组合成新分子分子原子在化学反应中失得电子在化学反应中失得电子离子表达方法均为微观粒子,既可讲个数,又可论种类。性质三种微粒都很小,一般用其相对质量表示质量;三种微粒都在不断地运动;且微粒间有间隙;三者皆为构成物质的一种微粒。(4)元素①概念——具有相同核电荷数的同一类原子的总称。②在地壳中前五位的元素③与原子的关系元素原子不同点概念元素是具有相同核电荷数的同一类原子的总称。如氢原子(H)和氢离子(H+)都属于氢元素原子是化学变化中的最小微粒含义元素只分种类,没有数量(个数)、大小和质量的含义原子有种类之分,又有数量、大小、质量的含义应用范围元素在说明物质宏观组成时应用原子是微观粒子,说明物质微观结构时应用联系具有相同核电荷数的同一类原子称为一种元素;原子是体现元素性质的最小微粒(5)物质、元素、分子、原子的相互关系学习必备欢迎下载(仅讲种类,不讲个数)(既讲种类,又讲个数)2.物质的组成:(1)混合物组成:宏观:用物质描述、用所含元素描述;微观:由分子组成描述。(2)纯净物组成:宏观:用物质描述、用所含元素描述;微观:由分子组成描述。3.物质的分类:(1)单质和化合物的区别和联系单质化合物区别概念由同种元素组成的纯净物由不同种元素组成的纯净物组成a:宏观:仅含有一种元素。b:微观:分子由同种元素的原子构成。a:宏观:含有两种或两种以上元素。b:微观:分子由不同种元素的原子构成。元素存在形态游离态化合态分类金属、非金属和稀有气体单质无机物:氧化物、酸、碱、盐等。有机物:甲烷、乙醇、乙酸等性质一般不能分解有些化合物在一定条件下能分解。联系都是纯净物,且有固定的组成。某些化合物在一定条件下分解某些不同单质发生化学反应单质化合物(2)纯净物和混合物的区别与联系纯净物混合物学习必备欢迎下载区别...