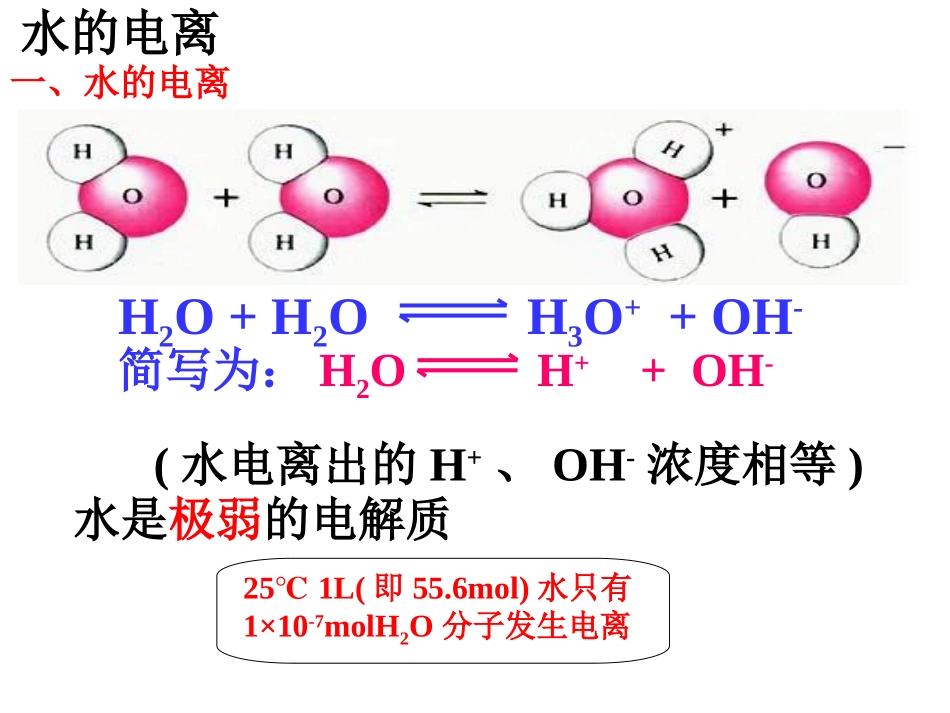
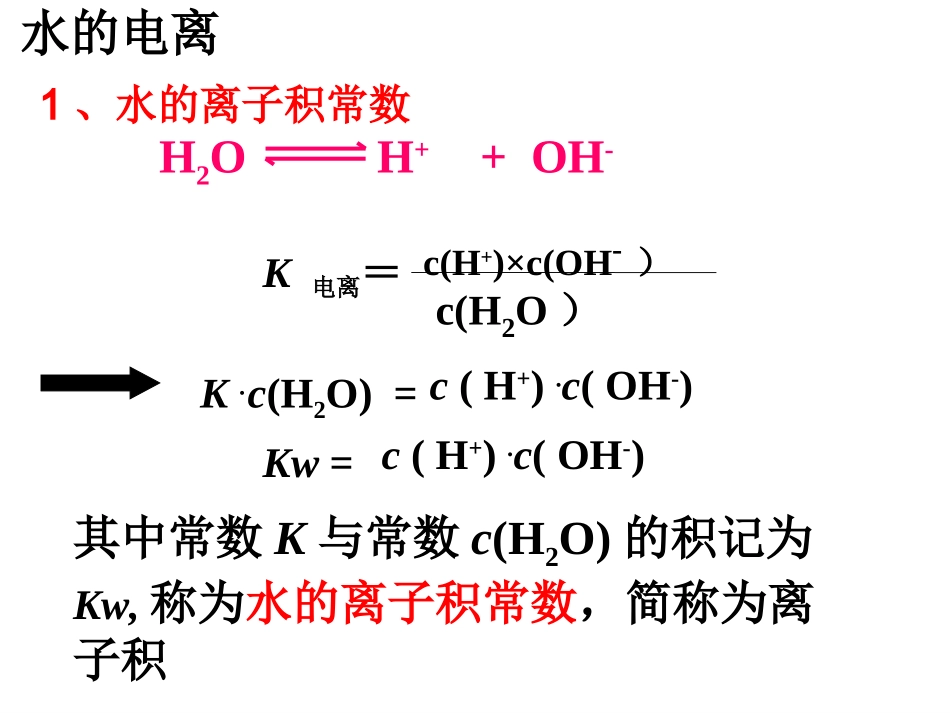
25/2/14潭市第一中学胡耀平1湘潭市一中欢迎您湘潭市一中高二化学组第一课时一、水的电离H2O+H2OH3O++OH-简写为:H2OH++OH-(水电离出的H+、OH-浓度相等)水是极弱的电解质251L℃(即55.6mol)水只有1×10-7molH2O分子发生电离水的电离K电离=c(H+)×c(OH-)c(H2O)K.=c(H+).c(OH-)c(H2O)Kw=c(H+).c(OH-)其中常数K与常数c(H2O)的积记为Kw,称为水的离子积常数,简称为离子积H2OH++OH-1、水的离子积常数水的电离KW=c(H+)·c(OH-)=1×10-1425℃时(常温)如果温度变化Kw会如何变化?为什么?实验测得:在25℃,水电离出来的c(H+)=c(OH-)=10-7mol/LKw100℃50℃25℃20℃0℃温度1.14×10-156.81×10-151×10-145.47×10-141×10-12水的电离水的电离吸热(1)升高温度,促进水的电离,Kw增大c(H+)=c(OH-)升高温度:平衡向移动,c(H+),c(OH-),Kw右增大增大增大注意:水的离子积只随温度的改变而改变2.影响水的电离平衡的因素H2OH++OH-Kw适用于一定温度下任何稀的电解质溶液水的电离对常温下的纯水进行下列操作:加NaOH加HCl加热Kwc(H+)c(OH-)浓度大小关系c(OH-)c(H+)水的电离平衡移动方向酸碱性条件(2)加入酸或碱,抑制水的电离,Kw不变。中性正反应增大增大c(H+)=c(OH-)增大酸性逆反应增大减小c(H+)>c(OH-)不变碱性逆反应减小增大c(H+)10-7<10-7c(H+)>c(OH-)酸性左移<10-7>10-7c(H+)