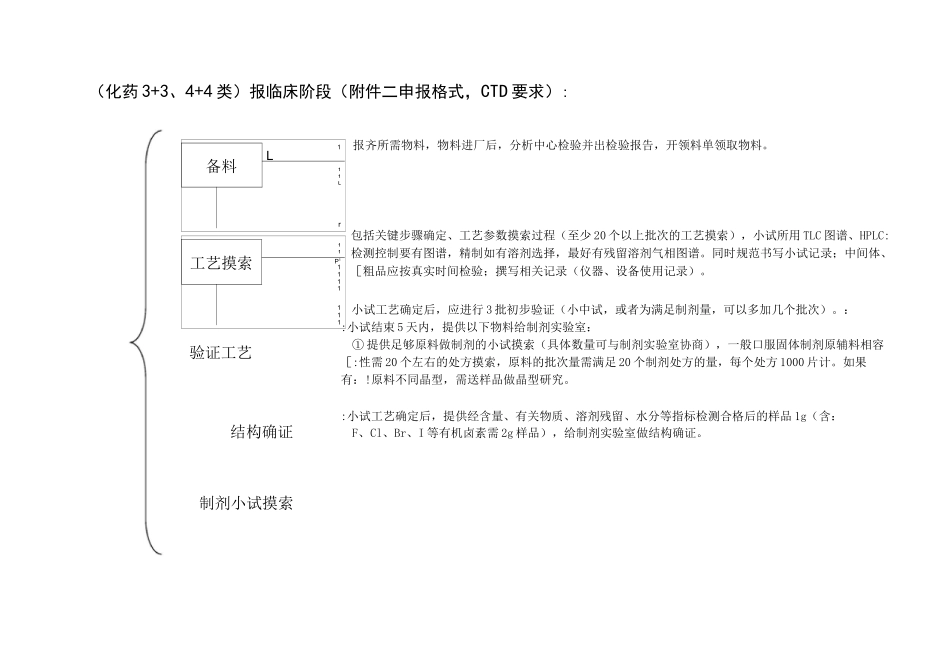
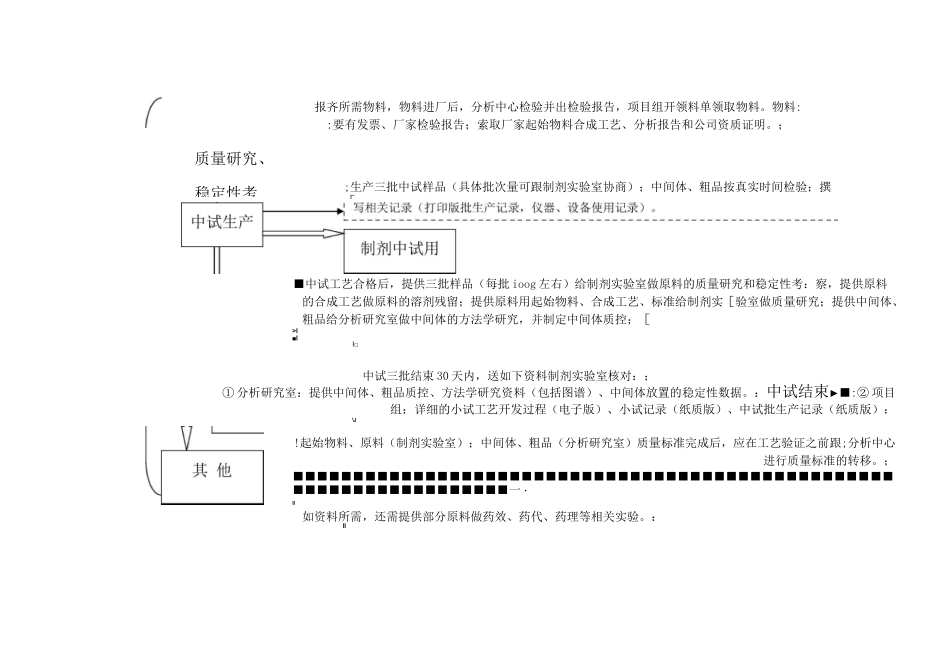
化学药品(原料)申报流程鉴于目前在研项目的原料+制剂主要集中在化药3+3类(先报临床后报生产);化药4+4类(先报临床后报生产)化药3+6类(原料直接报生产);化药6+6类(仿制药),特制订原料的申报流程如下:(化药3+3、4+4类)报临床阶段(附件二申报格式,CTD要求):备料1L11Lr工艺摸索11P11111111验证工艺结构确证制剂小试摸索报齐所需物料,物料进厂后,分析中心检验并出检验报告,开领料单领取物料。包括关键步骤确定、工艺参数摸索过程(至少20个以上批次的工艺摸索),小试所用TLC图谱、HPLC:检测控制要有图谱,精制如有溶剂选择,最好有残留溶剂气相图谱。同时规范书写小试记录;中间体、[粗品应按真实时间检验;撰写相关记录(仪器、设备使用记录)。小试工艺确定后,应进行3批初步验证(小中试,或者为满足制剂量,可以多加几个批次)。::小试结束5天内,提供以下物料给制剂实验室:①提供足够原料做制剂的小试摸索(具体数量可与制剂实验室协商),一般口服固体制剂原辅料相容[:性需20个左右的处方摸索,原料的批次量需满足20个制剂处方的量,每个处方1000片计。如果有:!原料不同晶型,需送样品做晶型研究。:小试工艺确定后,提供经含量、有关物质、溶剂残留、水分等指标检测合格后的样品1g(含:F、Cl、Br、I等有机卤素需2g样品),给制剂实验室做结构确证。质量研究、稳定性考报齐所需物料,物料进厂后,分析中心检验并出检验报告,项目组开领料单领取物料。物料::要有发票、厂家检验报告;索取厂家起始物料合成工艺、分析报告和公司资质证明。;■中试工艺合格后,提供三批样品(每批ioog左右)给制剂实验室做原料的质量研究和稳定性考:察,提供原料的合成工艺做原料的溶剂残留;提供原料用起始物料、合成工艺、标准给制剂实[验室做质量研究;提供中间体、粗品给分析研究室做中间体的方法学研究,并制定中间体质控;[>I■II□中试三批结束30天内,送如下资料制剂实验室核对:;①分析研究室:提供中间体、粗品质控、方法学研究资料(包括图谱)、中间体放置的稳定性数据。:中试结束►■:②项目组:详细的小试工艺开发过程(电子版)、小试记录(纸质版)、中试批生产记录(纸质版):\J!起始物料、原料(制剂实验室);中间体、粗品(分析研究室)质量标准完成后,应在工艺验证之前跟;分析中心进行质量标准的转移。;■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■一・II如资料所需,还需提供部分原料做药效、药代、药理等相关实验。:II;生产三批中试样品(具体批次量可跟制剂实验室协商);中间体、粗品按真实时间检验;撰[备料工艺;验证工艺验证¥样品留制剂工艺验上报资料撰|工艺验证完成20天内,送以下资料给制剂实验室,以备上报资料用::①8号资料(原料药生产工艺的研究资料及文献资料)|②工艺验证方案和报告、工艺验证批生产记录交给制剂实验室核对,迎接市局研制现场核告市局核查■资料申报,省局受理后,最短5日左右,市局进行研制现场核查(药物研制情况及原始资料、不抽样)[临床试验►;原料+制剂获得临床批件后,及时备齐物料生产一批原料,由分析中心出分析报告合格后送制剂室用于[临床用制剂样品的试制。「I报齐所需物料,物料进厂后,分析中心检验并出检验报告,协调车间开领料单领取物料。物料要:有发票、厂家检验报告;同时记录所用重要起始物料的批号,找到该批次的厂家检验报告和自检];报告备用。i原料稳定性考察3〜6个月内,生产三批中试或车间规模样品(具体批次量可跟制剂实验室协商)进[』行工艺验证;中间体、粗品及重要起始物料按照内控标准真实检验并找到分析中心检验报告备用;车[;间(或项目组)撰写相关记录(打印版批生产记录,工艺验证方案和报告,仪器、设备使用记录);::项目组撰写8号资料;同时送样品给分析中心出检验报告。报生产阶段(CTD申报格式):报生产工艺与报临床工艺一致直接生产3批工艺验证样品(车间规模),同时撰写CTD资料3・2・S・2・2〜-工艺验证V报生产工艺与报临|:继续重复小试、中试...