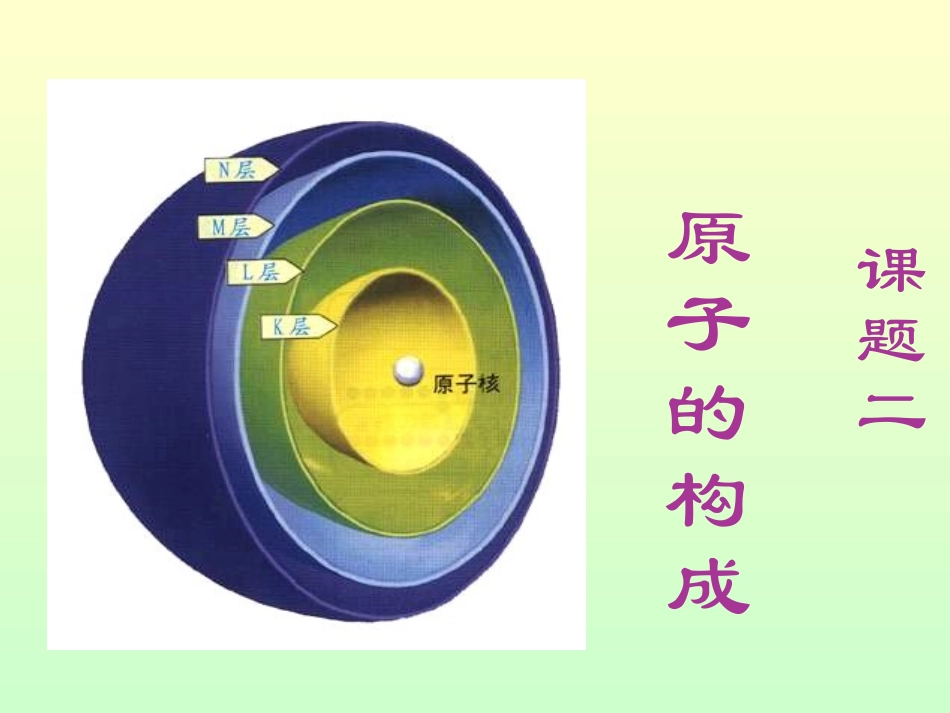
课题二原子的构成:物质可以由分子构成,也可以由原子直接构成。分子由原子构成。复习问题原子的特点是什么?原子是化学变化中的最小粒子原子的体积很小:•在化学反应里分子可以分为原子,原子不能再分,那么用其它方法能不能将原子再分呢?原子结构的发现史原子结构的发现史公元前公元前55世纪,古希腊哲学家德谟克世纪,古希腊哲学家德谟克利特等人认为:万物是由大量的不可分利特等人认为:万物是由大量的不可分割的微粒构成的。割的微粒构成的。““一尺之捶,日取其半,万世不竭”。一尺之捶,日取其半,万世不竭”。--------庄子庄子历史英国化学家道尔顿英国物理学家汤姆生英国科学家卢瑟福英国物理学家查德维克1803年实心球模型1918-1932年发现质子中子1897年枣糕模型1911年行星式有核模型1913年玻尔原子模型(又称分层模型)近代科学原子论(1803年)—道尔顿原子模型一切物质都是由最小的不能再分的粒子——原子构成。道尔顿原子模型道尔顿原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿(J.Dalton,1766~1844)原子并不是构成物质的最小微粒——汤姆生发现了电子汤姆生发现了电子(1897年)汤姆生原子模型•电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。•汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。α粒子散射实验(1909年)——原子有核卢瑟福原子模型卢瑟福和他的助手做了卢瑟福和他的助手做了著名著名aa粒子散射实验粒子散射实验。。根据实验,卢瑟福在根据实验,卢瑟福在19111911年提出原子有核模年提出原子有核模型。型。卢瑟福原子模型卢瑟福原子模型(又称(又称行星原子模型):原子行星原子模型):原子是由居于原子中心的带是由居于原子中心的带正电的原子核和核外带正电的原子核和核外带负电的电子构成。原子负电的电子构成。原子核的质量几乎等于原子核的质量几乎等于原子的全部质量,的全部质量,电子在原电子在原子核外空间绕核做高速子核外空间绕核做高速运动。运动。玻尔原子模型(1913年)玻尔改进了卢瑟福的模型。玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。不同的电子运转是具不同的电子运转是具有一定的稳定轨道。有一定的稳定轨道。4.卢瑟福的轰炸金箔实验英国物理学家卢瑟福英国物理学家卢瑟福αα粒子散射实验粒子散射实验大部分α粒子在穿过金属箔片;少数的α粒子方向明显发生大角度改变原子不是简单而不可分割的实心球体。原子是由居于原子中心的带正电的原子核原子核和核外带负电的电子核外带负电的电子构成,电子在原子核外绕核做高速运动。电子在原子核外绕核做高速运动。那么原子核又是怎样构成的呢?通过原子模型的演变我们知道:实验证明:原子核是由带正电的质子质子和不带电的中子中子构成。如:碳原子原子原子核核外电子质子中子一、原子的构成原子核原子原子核比原子小得多质子、中子、电子的电性和电量怎样?1个质子带一个单位正电荷;1个电子带一个单位负电荷。中子不带电;原子核带正电原子核所带的正电荷数目叫做核电荷数核电荷数=核内质子数1个质子带1个单位正电荷,中子不带电,因此原子核带正电荷。原子核所带的正电荷数目叫做核电荷数,它在数值上等于原子核所含的质子数目。原子种类原子核核外电子数核电荷数质子数中子数氢1101碳6666氧8888钠11111211铁26263026从表中可以得出:1、原子中,质子数=核外电子数;2、核内质子数就是核电荷数;3、质子数不一定等于中子数,原子中不一定含有中子;4、构成原子的必要粒子是质子和电子,决定原子种类的是核内质子数,它必不可少。5.核电荷数=质子数=核外电子数即是:核电荷数=质子数=核外电子数问题:原子中存在带电荷的粒子(质子和电子),原子是否显电性?原子不显电性的原因:由于原子核所带电量和核外电子的电量相等,但电性相反,所以整个原子不显电性。分析表格阅读下表(4-1),你能得出什么结论呢?构成原子的粒子种类各粒子的电性各粒子的质量(kg)质子1个单位正电荷1.6726×10-...