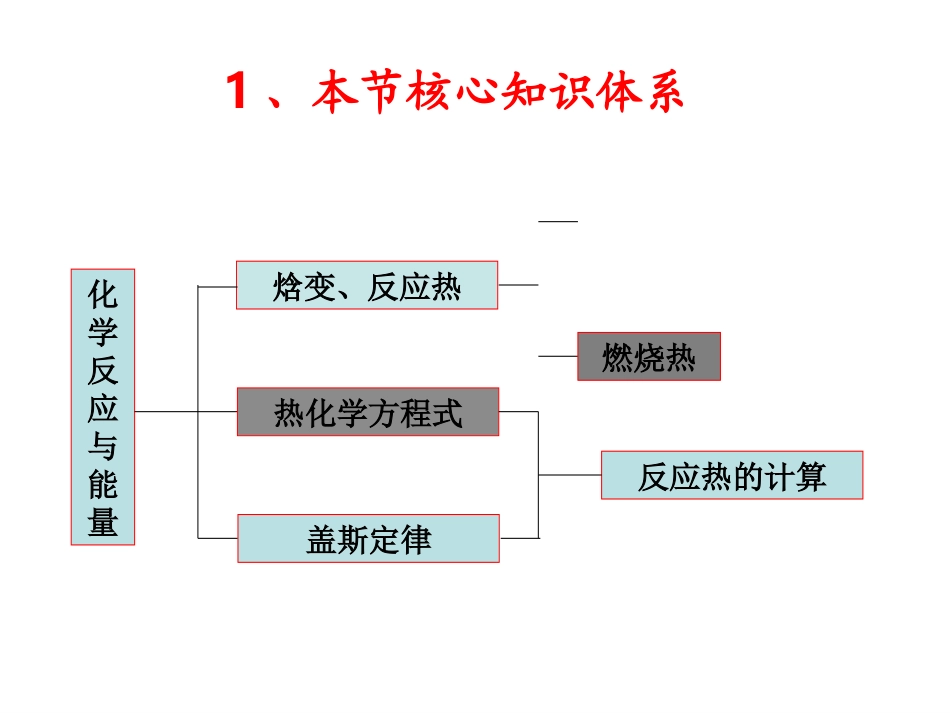
一、反应热、焓变1、反应热2、焓和焓变3、反应热和焓变复习回顾二、微观探究化学反应中能量变化的源泉四、用键能计算反应热三、放热反应和吸热反应与△H正负的关系1、本节核心知识体系化学反应与能量焓变、反应热热化学方程式盖斯定律反应热的计算燃烧热1、热化学方程式概念表示参加反应的物质的量和反应热的关系的化学方程式,叫做热化学方程式。能表示参加反应物质的量和反应热的关系的化学方程式H2(g)+I2(g)======2HI(g)△H=-14.9kJ/mol200℃101kPa1、热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。普通化学方程式只包含物质变化一个部分。物质变化能量变化2、热化学方程式与普通化学反应的差异能表示参加反应物质的量和反应热的关系的化学方程式H2(g)+I2(g)======2HI(g)△H=-14.9kJ/mol200℃101kPa2、热化学方程式需注明反应时的温度和压强。对于25℃101kPa时进行的反应可不注明。普通化学方程式不需注明温度和压强。H2(g)+O2(g)==H2O(g)△H=-241.8kJ/mol122、热化学方程式与普通化学反应的差异能表示参加反应物质的量和反应热的关系的化学方程式3、热化学方程式需注明各物质的状态。普通化学方程式不需注明物质的状态。H2(g)+O2(g)==H2O(g)△H=-241.8kJ/mol12H2(g)+O2(g)==H2O(l)△H=-285.8kJ/mol122、热化学方程式与普通化学反应的差异能表示参加反应物质的量和反应热的关系的化学方程式4、热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数。普通化学方程式中化学计量数宏观上表示各物质的物质的量,微观上表示原子分子数目,只能为整数,不能为分数。H2(g)+O2(g)==H2O(g)△H=-241.8kJ/mol122H2(g)+O2(g)==2H2O(g)△H=-483.6kJ/mol阅读P4《资料卡片》★kJ/mol的含义:每mol反应的焓变2、热化学方程式与普通化学反应的差异问题:反应物和生成物前的系数它代表了什么?在方程式中∆H它表示了什么意义?∆H它的值与什么有关系?1、当1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6KJ的热量,请写出该反应的热化学方程式。H2(g)+Cl2(g)=2HCl(g)∆H=-184.6KJ/mol而这些书写也是对的!!!1、化学方程的右边必须写上△H,并用“空格”隔开,△H:吸热用“+”,放热用:“-”,单位是kJ/mol或J/mol2、需注明反应的温度和压强,如不注明条件,即指:25℃1.01×105Pa;3、物质后需标聚集状态(s、l、g、aq)4、热化学方程式中各物质化学式前面的化学计量数仅表示物质的量并不能表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数5、根据焓的性质,若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变6、不论反应是否可逆,热化学方程式中反应热指代完全转化时的热量变化做笔记2、热化学方程式与普通化学反应的差异1、3molCH4燃烧时,生成液态水和CO2同时放出2670.9KJ的热。请写出热化学方程式。2、常温下14克CO在足量氧气中充分燃烧,放出141.3KJ热量,写出该热化学方程式。CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ2CO(g)+O2(g)=2CO2(g)H△=-565.2KJ3、1molC与1mol水蒸气反应生成1molCO和1molH2,需要吸收131.5kJ的热量。写出此反应的热化学方程式。4、沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和H2O时,放出445kJ的热量。则下列热化学方程式中正确的是A、2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)ΔH=+890kJ/molB、CH4+2O2=CO2+H2OΔH=-890kJ/molC、CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890kJ/molD、1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l)ΔH=-890kJ/molC(s)+2H2O(g)=CO(g)+2H2(g)H△=+131.5KJ5、已知(1)H2(g)+1/2O2(g)=H2O(g)ΔH1=akJ/mol(2)2H2(g)+O2(g)=2H2O(g)ΔH2=bkJ/mol(3)H2(g)+1/2O2(g)=H2O(l)ΔH3=ckJ/mol(4)2H2(g)+O2(g)=2H2O(l)ΔH4=dkJ/mol则a、b、c、d的关系正确的是。A、ad>0C、2a=b<0D、2c=d>06、已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P198kJ·mol-1、P-O360kJ·mol-1、氧气分子内氧原子间的键能为498kJ·mol-1则反应P4+3O2=P4O6的反应热△H为(B)A....