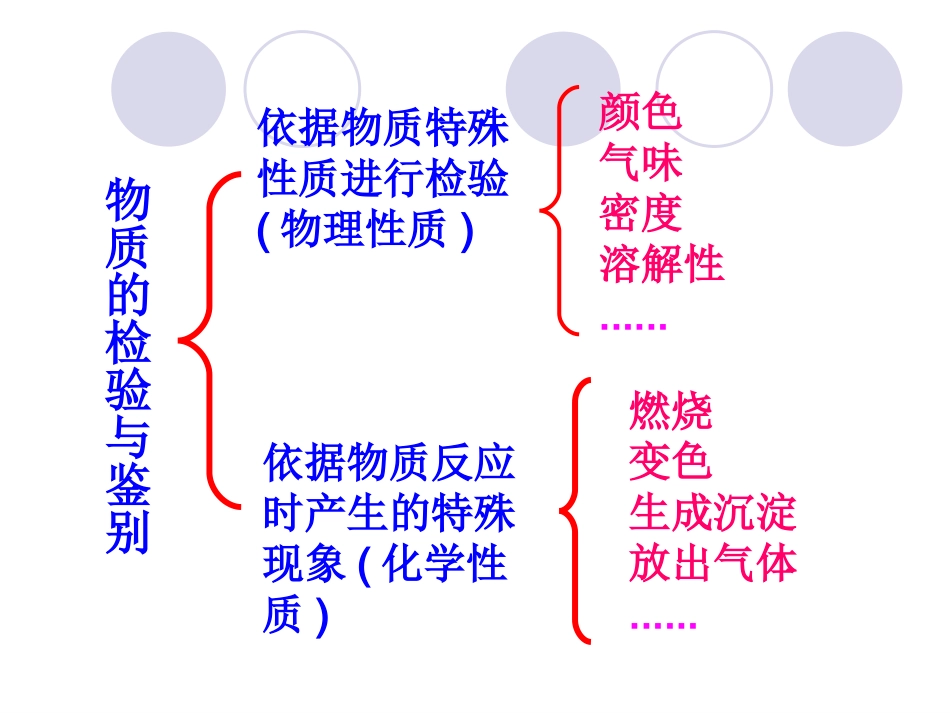
专题一化学家眼中的物质世界第一单元丰富多彩的化学物质常见物质的检验常见物质的检验依据物质特殊性质进行检验(物理性质)颜色气味密度溶解性......燃烧变色生成沉淀放出气体......依据物质反应时产生的特殊现象(化学性质)物质的检验与鉴别CuSO4溶液FeCl3溶液NaOHMg(OH)2NaOH溶液H2SO4溶液颜色溶解度气体的溢出颜色的变化Na2CO3Na2SO4待检物质检验方法现象O2CO2H2碳酸盐(CO32-)酸(H+)碱(OH-)淀粉丝绸制品用带火星的木条放在装满氧气的集气瓶口带火星的木条复燃,(利用氧气可燃性)点燃与盐酸反应,产生气体通入澄清石灰水有气体产生,澄清石灰水变浑浊用紫色石蕊试液;用pH试纸紫色石蕊变红;pH试纸变色pH<7用紫色石蕊试液;用pH试纸紫色石蕊变蓝;pH试纸变色pH>7与碘水反应变蓝灼烧有烧焦羽毛的气味将气体通入澄清石灰水澄清石灰水变浑浊用冷的烧杯罩在火焰上方有水珠生成,向烧杯中注入Ca(OH)2不浑浊常见试纸:pH试纸:红色石蕊试纸:即广范试纸。石蕊试纸遇碱性物质变蓝色蓝色石蕊试纸:遇酸性物质变红淀粉试纸碘淀粉蓝蓝检验液体时应注意?1、检验液体时不能先湿润(定量时)2、放在洁净表面皿用玻璃棒蘸取待测液检验用试纸检验气体需注意?试纸先湿润实验实验1:NH1:NH44++的检验的检验实验步骤:①取两支试管,分别加入_____ml的NH4Cl和(NH4)2SO4溶液。②再各加入___________溶液。③分别加热两支试管,并将________的_____________试纸靠近__________,观察试纸的颜色变化。实验现象:实验结论:有刺激性气味气体产生,且该气体能使湿润的pH试纸变蓝。NHNH44ClCl和和(NH(NH44))22SOSO44中含有中含有NHNH44++NH4Cl+NaOH—(NH4)2SO4+2NaOH—化学方程式:22mlNaOH湿润红色石蕊试纸试管口取样(少量放在试管中)与碱液混合加热,若有能使湿润的红色石蕊试纸变蓝的气体产生,证明该试样中含有NH4+。归纳1:NH4+(铵盐)的检验方法:NH4Cl+NaOH==NaCl+H2O+NH3↑(NH4)2SO4+2NaOH==Na2SO4+2H2O+2NH3↑NH3使湿润的红色石蕊试纸变蓝蓝实验原理:实验实验22::ClCl--的检验的检验实验步骤:①取两支试管,分别加入少量的_______________溶液。②再各加入几滴________________溶液,观测实验现象。实验现象:实验结论:加入AgNO3溶液后,出现白色沉淀,沉淀不溶解溶液中的离子遇AgNO3产生不溶于硝酸的白色沉淀,说明含Cl-KCl+AgNOKCl+AgNO33——NHNH44Cl+AgNOCl+AgNO33——化学方程式:稀HNO3的作用是什么?能改用稀HCl或H2SO4吗?排除CO32-、SO32-和SO42-的干扰SOSO332-2-硝酸硝酸SOSO442-2-NH4ClKClHNO3和AgNO3实验原理:KCl+AgNOKCl+AgNO33=KNO=KNO33+AgCl↓+AgCl↓NHNH44Cl+AgNOCl+AgNO33=NH=NH44NONO33+AgCl↓+AgCl↓AgClAgCl不溶于稀不溶于稀HNO3取样并向内加入稀HNO3,再加入AgNO3溶液,若生成白色沉淀并且沉淀不溶解,证明该试样中含有Cl-。归纳2:Cl-的检验方法:实验实验33::SOSO442-2-的检验的检验实验步骤:①取两支试管,分别加入少量的_____________溶液。②再各加入几滴_________________,观测实验现象。实验现象:实验结论:反应生成不溶于稀盐酸的白色沉淀反应生成不溶于稀盐酸的白色沉淀硫酸铵、硫酸钾中含有硫酸铵、硫酸钾中含有SOSO442-2-(NH4)2SO4+BaCl2—K2SO4+BaCl2—化学方程式:排除SO32-、CO32-、Ag+的干扰硝酸具有氧化性SOSO332-2-SOSO442-2-(NH4)2SO4、K2SO4稀盐酸和BaCl2溶液稀HCl的作用是什么?能改用稀HNO3或H2SO4吗?实验原理:(NH4)2SO4+BaCl2=2NH4Cl+BaSO4↓K2SO4+BaCl2=2KCl+BaSO4↓BaSO4不溶于稀盐酸取样并向内加稀盐酸,无沉淀生成,再加入BaCl2溶液,若生成白色沉淀,证明该试样中含有SO42-。归纳3:SO42-(硫酸盐)的检验方法注意:焰色反应是指金属元素的性质很多金属或它们的化合物在灼烧时都很多金属或它们的化合物在灼烧时都会使会使火焰呈现出特殊的颜色,这在化学上叫做火焰呈现出特殊的颜色,这在化学上叫做焰色焰色反应反应。。取一根铂丝(或铁丝),放在酒精灯的火焰上灼烧至无色。用铂丝蘸取少量KCl溶液,置于火焰上灼烧,透过蓝色钴玻璃观察火焰颜色。再用稀盐酸洗净铂丝,并在火焰上灼烧至无色,蘸取少量K2SO4溶液,重复以上实验。实验...