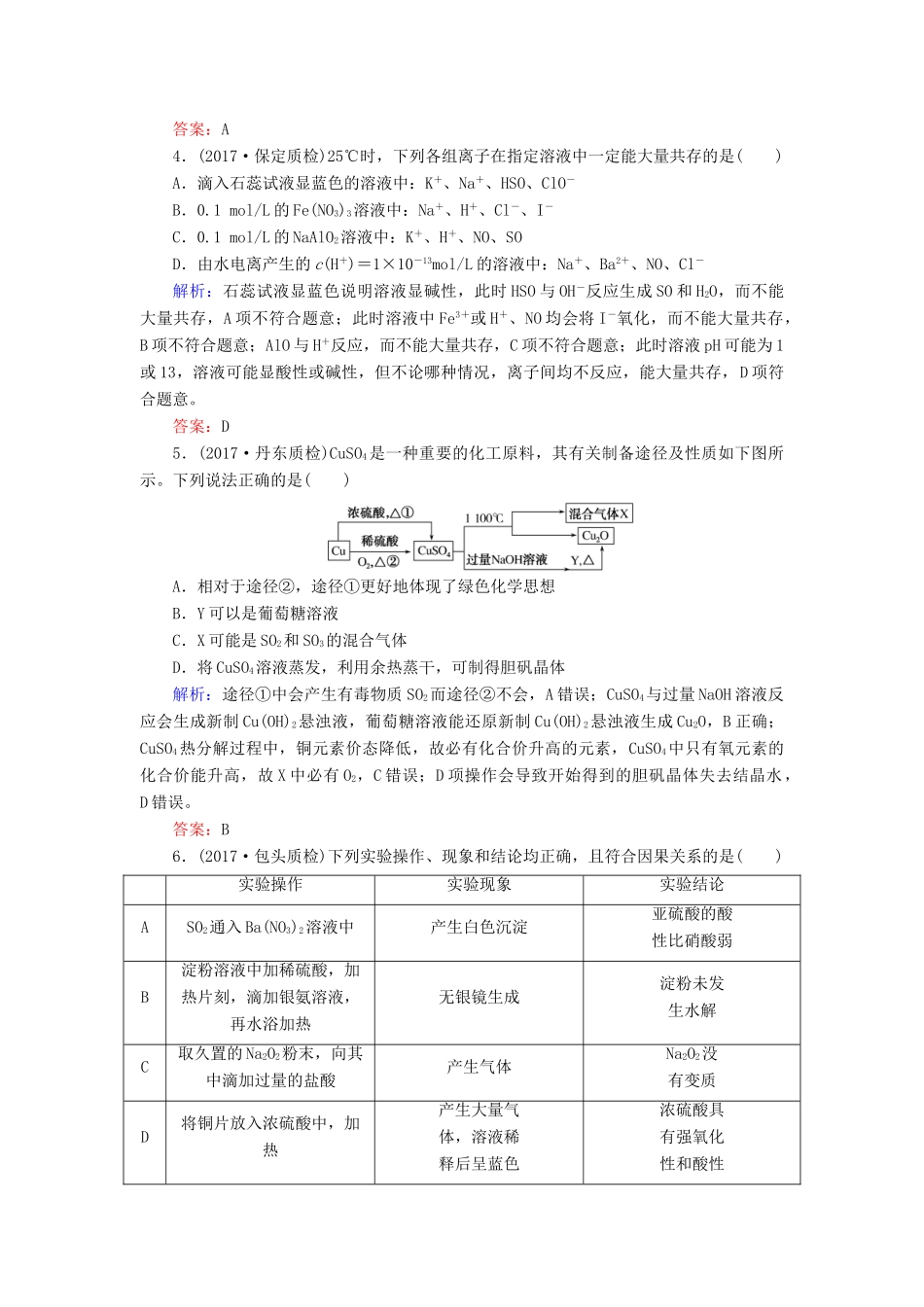
考点滚动练(二)(第三章、第四章)一、选择题1.(2017·石家庄模拟)化学与生产、生活密切相关,下列有关说法不正确的是()A.在日光照射下,NO2与空气中的一些碳氢化合物发生作用会产生光化学烟雾B.研制性能优良的催化剂可使反应所需温度降低,加快反应速率,起到很好的节能效果C.同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃两个不同的反应条件下ΔH不同D.自来水厂可使用Cl2和绿矾(FeSO4·7H2O)进行消毒、净化,可改善水质解析:NO2与大气中的碳氢化合物在阳光紫外线作用下发生光化学反应,产生的混合污染物形成光化学烟雾,A项正确;催化剂能降低反应的活化能,从而使反应所需温度降低,加快反应速率,B项正确;反应热的大小取决于反应物总能量与生成物总能量的相对大小,与反应条件无关,C项错误;Cl2具有较强的氧化性,可将自来水中细菌氧化至死,同时Cl2可将绿矾中Fe2+氧化为Fe3+,Fe3+在自来水中水解可得到Fe(OH)3胶体,Fe(OH)3胶体粒子可吸附自来水中的悬浮物质而沉降,达到净水的目的,D项正确。答案:C2.下列离子方程式正确的是()A.Na2CO3溶液呈碱性:CO+2H2OH2CO3+2OH-B.NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++2OH-+2HCO===CaCO3↓+CO+2H2OC.漂白粉溶液中通入足量二氧化硫气体:ClO-+SO2+H2O===HClO+HSOD.向NaAlO2溶液中通入过量CO2:AlO+CO2+2H2O===Al(OH)3↓+HCO解析:多元弱酸根离子的水解是分步进行的,A项错误;NaHCO3溶液中加入过量Ca(OH)2溶液,正确的离子方程式为Ca2++OH-+HCO===CaCO3↓+H2O,B项错误;漂白粉溶液中通入足量SO2气体,发生氧化还原反应,生成SO和Cl-,C项错误。答案:D3.(2017·济南模拟)镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示。反应中镁和铝的()A.物质的量之比为3:2B.质量之比为3:2C.摩尔质量之比为2:3D.反应速率之比为2:3解析:由图像可知,两个反应中生成的氢气一样多,则镁、铝的物质的量之比为3:2,质量之比为4:3,故A正确,B错误;镁、铝的摩尔质量之比为8:9,C错误;由图像可知产生等量的氢气,镁、铝与硫酸反应需要的时间之比为2:3,则二者的速率之比为3:2,D错误。答案:A4.(2017·保定质检)25℃时,下列各组离子在指定溶液中一定能大量共存的是()A.滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO、ClO-B.0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl-、I-C.0.1mol/L的NaAlO2溶液中:K+、H+、NO、SOD.由水电离产生的c(H+)=1×10-13mol/L的溶液中:Na+、Ba2+、NO、Cl-解析:石蕊试液显蓝色说明溶液显碱性,此时HSO与OH-反应生成SO和H2O,而不能大量共存,A项不符合题意;此时溶液中Fe3+或H+、NO均会将I-氧化,而不能大量共存,B项不符合题意;AlO与H+反应,而不能大量共存,C项不符合题意;此时溶液pH可能为1或13,溶液可能显酸性或碱性,但不论哪种情况,离子间均不反应,能大量共存,D项符合题意。答案:D5.(2017·丹东质检)CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法正确的是()A.相对于途径②,途径①更好地体现了绿色化学思想B.Y可以是葡萄糖溶液C.X可能是SO2和SO3的混合气体D.将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体解析:途径①中会产生有毒物质SO2而途径②不会,A错误;CuSO4与过量NaOH溶液反应会生成新制Cu(OH)2悬浊液,葡萄糖溶液能还原新制Cu(OH)2悬浊液生成Cu2O,B正确;CuSO4热分解过程中,铜元素价态降低,故必有化合价升高的元素,CuSO4中只有氧元素的化合价能升高,故X中必有O2,C错误;D项操作会导致开始得到的胆矾晶体失去结晶水,D错误。答案:B6.(2017·包头质检)下列实验操作、现象和结论均正确,且符合因果关系的是()实验操作实验现象实验结论ASO2通入Ba(NO3)2溶液中产生白色沉淀亚硫酸的酸性比硝酸弱B淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热无银镜生成淀粉未发生水解C取久置的Na2O2粉末,向其中滴加过量的盐酸产生气体Na2O2没有变质D将铜片放入浓硫酸中,加热产生大量气体,溶液稀释后呈蓝色浓硫酸具有强氧化性和酸性解析...