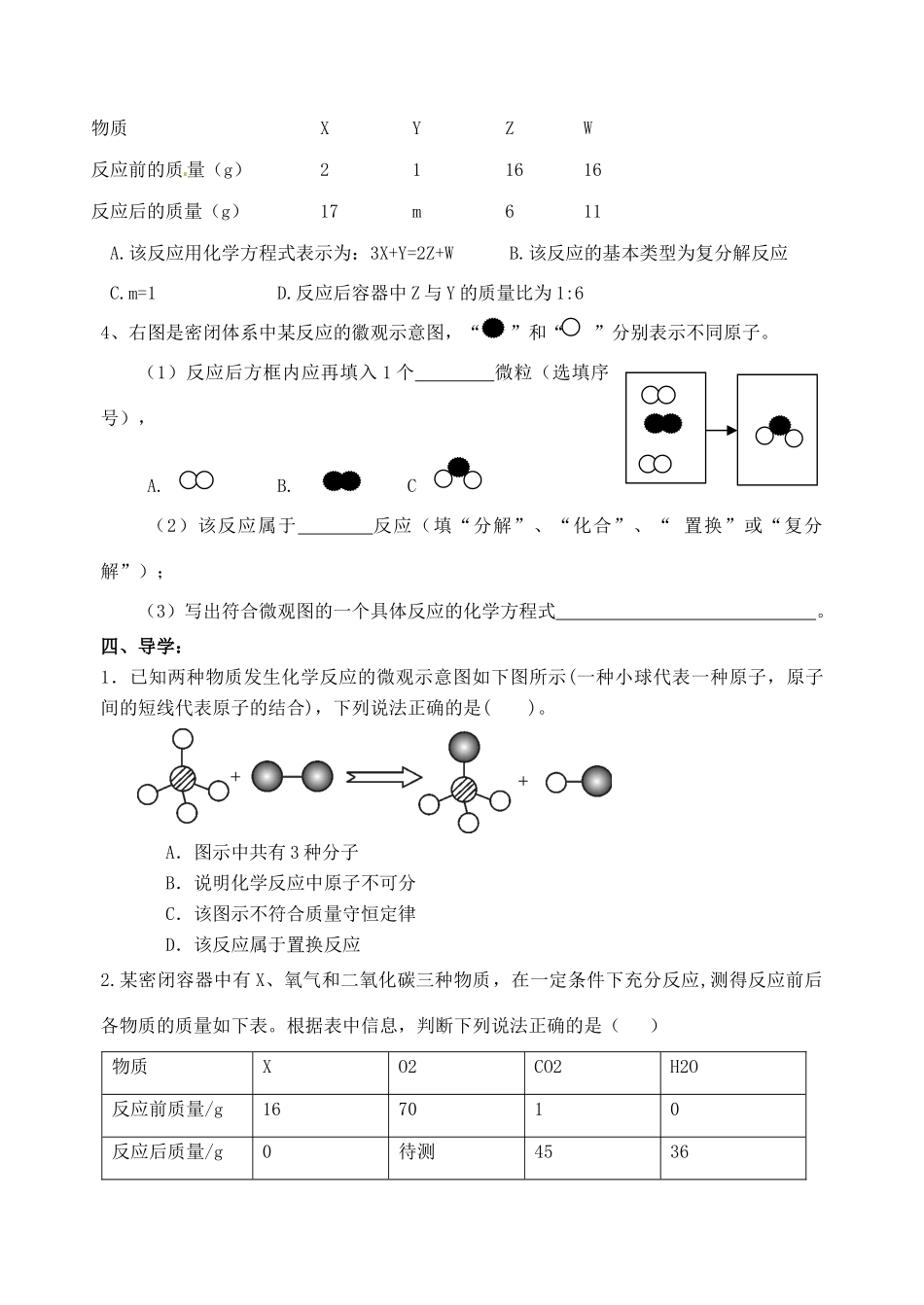
质量守恒定律的应用一、知识梳理1、基本内容(定义):。2、质量守恒的理解宏观(1)五个不变微观宏观:(2)两个一定改变微观:分子总数可能改变。(3)两个可能改变:元素的化合价可能改变。3、运用质量守恒定律解释实验现象的一般步骤:①说明化学反应的反应物和生成物;②根据质量守恒定律,应该是参加化学反应的各物质质量总和等于各生成物质量总和③与题目中实验现象相联系,说明原因。4、利用原子、分子知识解释质量守恒原因解释“质量守恒”要从化学反应的实质去分析,由分子构成的物质在化学反应中的实质是:分子分裂成原子,原子从新组合成分子,分子聚集成新物质。在化学反应中,不论物质分子经过怎样的变化,但反应前后原子种类和数目都不变,各原子质量也不变。所以,反应前后的质量总和必然相等。5、适用范围:所有的化学变化。6、验证实验:当有气体参加反应或有气体生成时,该反应必须在密闭容器内进行才能验证质量守恒定律。二、自学自测:1、某化合物在纯氧中燃烧生成二氧化碳和二氧化硫,则此化合物中一定含有和两种元素,可能含有元素。2、在奥运比赛中,举重运动员举重前常用白色的“镁粉”搓手,是因为“镁粉”质轻、吸水性好,可做防滑剂。“镁粉”的有效成分是碱式碳酸镁,它不可燃,300℃即分解,其分解的化学方程式是:Mg5(OH)2(CO3)4△5MgO+X+4CO2↑,则X的化学式为()A.O2B.COC.Mg(OH)2D.H2O3.一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如下表所示,下列说法正确的是()物质CO2O2H2OW反应前质量(g)658523反应后质量(g)X10320A.该反应属于化合反应B.W是一种由碳、氢两种元素组成的化合物C.W是一种由碳、氢、氧三种元素组成的化合物D.X的值为44三、互学:1.小明同学从S+O2SO2中获得以下信息:①该反应中反应物是硫和氧气;②该反应发生的条件是点燃;③反应前后元素种类和原子个数保持不变;④反应前后分子总数保持不变;⑤参加反应和硫和氧气的质量比为2:1。其中正确的信息是()A、①②④⑤B、①②③C、④⑤D、①②③⑤2.氯碱工业的反应原理是电解饱和食盐水,下列物质不可能是氯碱工业产品的是()A.H2B.Cl2C.Na2CO3D.NaOH3.在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识正确的是()物质XYZW反应前的质量(g)211616反应后的质量(g)17m611A.该反应用化学方程式表示为:3X+Y=2Z+WB.该反应的基本类型为复分解反应C.m=1D.反应后容器中Z与Y的质量比为1:64、右图是密闭体系中某反应的徽观示意图,“”和“”分别表示不同原子。(1)反应后方框内应再填入1个微粒(选填序号),A.B.C(2)该反应属于反应(填“分解”、“化合”、“置换”或“复分解”);(3)写出符合微观图的一个具体反应的化学方程式。四、导学:1.已知两种物质发生化学反应的微观示意图如下图所示(一种小球代表一种原子,原子间的短线代表原子的结合),下列说法正确的是()。A.图示中共有3种分子B.说明化学反应中原子不可分C.该图示不符合质量守恒定律D.该反应属于置换反应2.某密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表。根据表中信息,判断下列说法正确的是()物质XO2CO2H2O反应前质量/g167010反应后质量/g0待测4536A.该反应为置换反应B.X中一定含有碳、氢两种元素C.表中“待测”值为5D.反应生成的CO2和H2O的质量比为45:363.下图是甲、乙两组同学分别设计的质量守恒定律的两个验证实验。请根据图示进行思考回答(假设甲、乙两组药品混合前质量均为m前、混合后质量均为m后):(1)甲组药品混合前后质量关系为m前>m后,请解释原因:________________________________________________________________________。该实验若试剂不变,应如何改进此装置:________________________________。(2)乙组药品混合前后质量关系为m前=m后,乙组同学认为实验成功,甲组同学认为该实验不能验证质量守恒定律,原因是__________________________________________。五、反馈练习:1.工业上利用下列反应制取金属Hg:4HgS+4CaO=4...