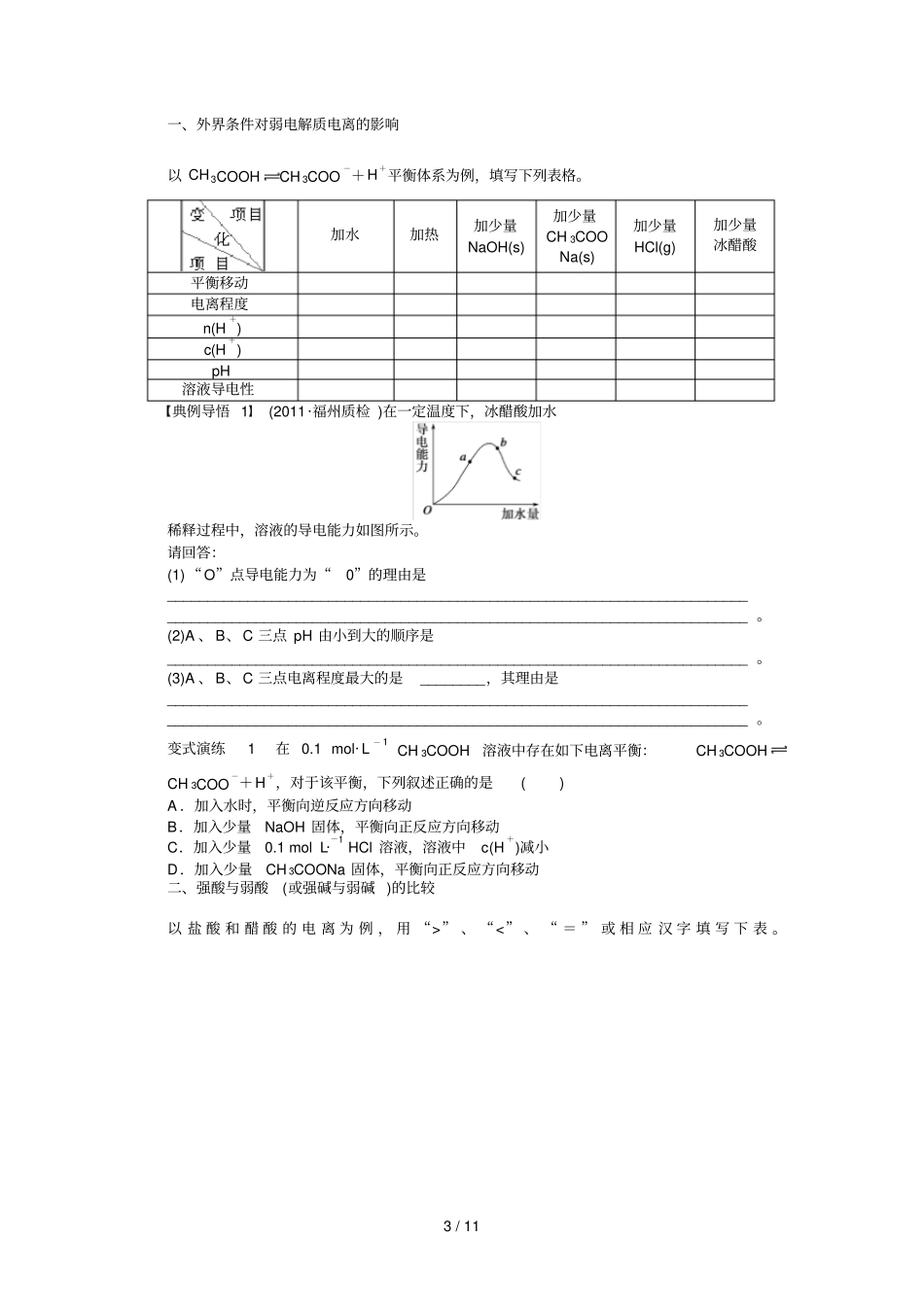
1 / 11 第十章水溶液中的离子平衡学案 45弱电解质的电离平衡[ 考纲要求 ]1.了解电解质的概念,了解强电解质和弱电解质的概念。2.了解电解质在水溶液中的电离,以及电解质溶液的导电性。3.了解弱电解质在水溶液中的电离平衡。知识点一强、弱电解质1.电解质与非电解质(1) 电解质:在 ________里或 ________状态下能导电的________;(2) 非电解质:在水溶液里和熔融状态下______不能导电的 ________。2.强电解质和弱电解质(1) 概念(2) 与化合物类型的关系强电解质主要是大部分________ 化合物及某些________化合物。弱电解质主要是某些________化合物。问题思考1.(1)强电解质溶液的导电能力一定比弱电解质导电能力强吗?(2) 能导电的物质一定是电解质吗?2.强电解质一定易溶于水吗?易溶于水的电解质一定是强电解质吗?3.电离方程式的书写(1) 强电解质用 ______,弱电解质用 ______。(2) 多元弱酸分步电离,且第一步电离程度远远大于第二步,如碳酸电离方程式:________________________________________________________________________ ,________________________________________________________________________ 。(3) 多元弱碱电离方程式一步写成,如氢氧化铁电离方程式:________________________________________________________________________ 。知识点二弱电解质的电离平衡1.概念弱电解质的电离平衡是指在一定条件下(温度、浓度),弱电解质__________的速率和______________的速率相等的状态。如下图所示:2 / 11 2.特征3.外界条件的影响电离平衡是一个吸热过程,主要受温度、浓度的影响。(1) 浓度:增大弱电解质的浓度,电离平衡________移动,溶质分子的电离程度减小;增大离子的浓度,电离平衡向左移动,溶质分子的电离程度________。(2) 温度:升高温度,电离平衡______移动,电离程度增大;降低温度,电离平衡向左移动,电离程度 ________。问题思考3.电离平衡右移,电解质分子的浓度一定减小吗?离子的浓度一定增大吗?知识点三电离常数1.表达式对一元弱酸HA :HAH++A-K a= ____________。对一元弱碱BOH :BOHB++OH-K b=______________。2.特点(1) 电离常数只与 __________有关,升温, K 值________。(2) 多元弱酸的各级电离常数的大小关系是Ka1? Ka2? K a3,所以其酸性主要决定于第一步电离。3.意义电离常数数值的大小,可以估算弱电解质电离的趋势。K 值越大...