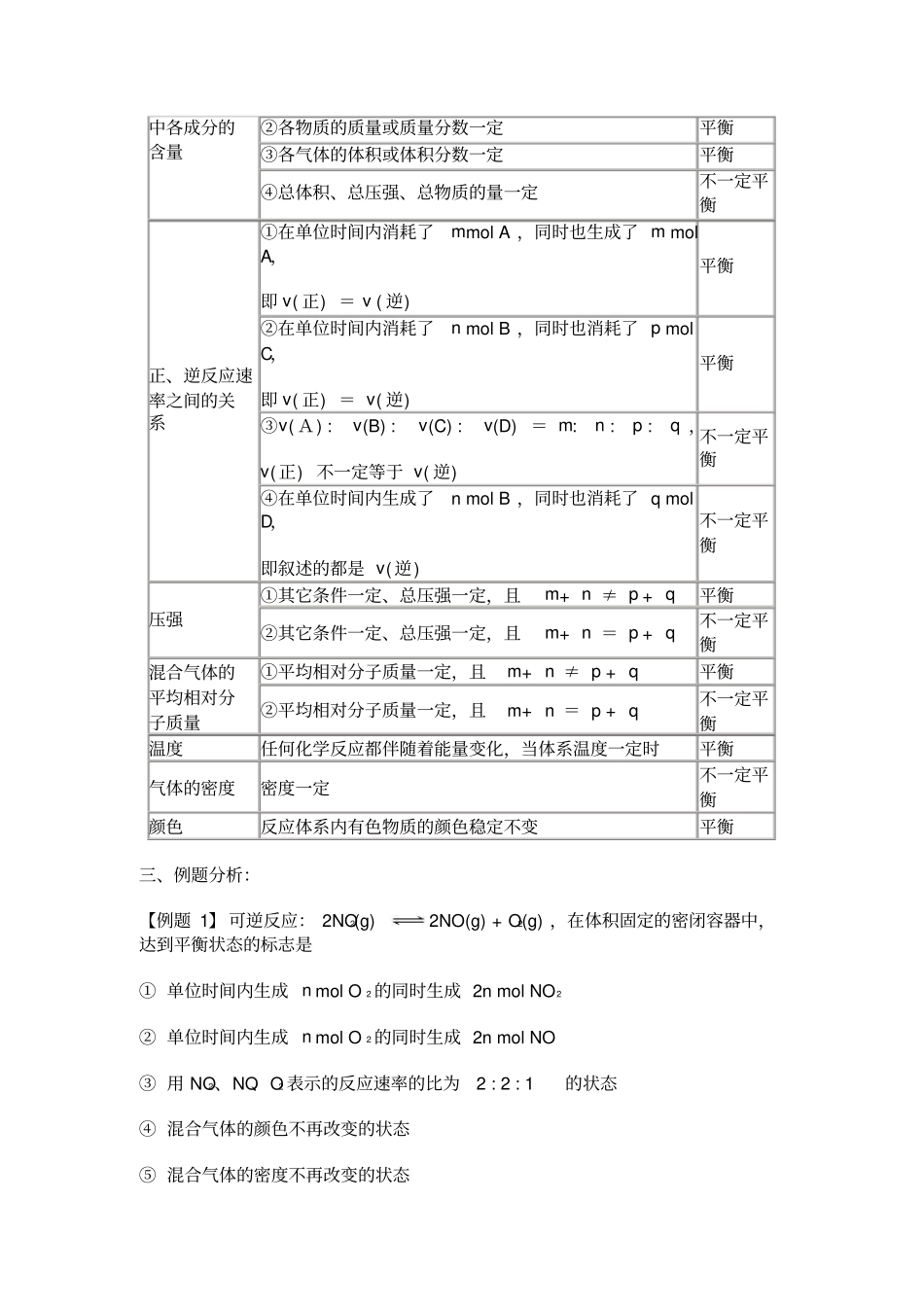
可逆反应达到平衡状态的标志及判断在一定条件下的可逆反应里, 当正反应速率与逆反应速率相等时,反应物和生成物的物质的量浓度不再发生改变的状态,叫化学平衡状态。其特点有:(1)“逆”:化学平衡研究的对象是可逆反应。(2)“等”:化学平衡的实质是正、逆反应速率相等,即:v( 正) = v(逆)。(3)“动”: v(正) = v( 逆) ≠0 (4)“定”:平衡体系中,各组分的浓度、质量分数及体积分数保持一定(但不一定相等),不随时间的变化而变化。(5)“变”:化学平衡是在一定条件下的平衡,若外界条件改变,化学平衡可能会分数移动。(6)“同”:在外界条件不变的前提下,可逆反应不论采取何种途径,即不论由正反应开始还是由逆反应开始,最后所处的平衡状态是相同的,即同一平衡状态。可逆反应达到平衡状态的标志及判断方法如下:以 mA(g) + nB(g) p C(g)+ qD(g) 为例:一、直接标志:①速率关系:正反应速率与逆反应速率相等,即:A消耗速率与 A的生成速率相等, A消耗速率与 C的消耗速率之比等于m : p ;②反应体系中各物质的百分含量保持不变。二、间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+ n ≠ p+ q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变。对于密闭容器中的可逆反应:mA(g) + nB(g) pC(g)+ qD(g) 是否达到平衡还可以归纳如下表:化学反应mA(g) + nB(g) pC(g)+ qD(g) 是否平衡混合物体系①各物质的物质的量或物质的质量分数一定平衡中各成分的含量②各物质的质量或质量分数一定平衡③各气体的体积或体积分数一定平衡④总体积、总压强、总物质的量一定不一定平衡正、逆反应速率之间的关系①在单位时间内消耗了m mol A ,同时也生成了 m mol A,即 v( 正) = v ( 逆) 平衡②在单位时间内消耗了n mol B ,同时也消耗了 p mol C,即 v( 正) = v( 逆) 平衡③v( A) : v(B) : v(C) : v(D) = m : n : p : q ,v( 正) 不一定等于 v( 逆) 不一定平衡④在单位时间内生成了n mol B ,同时也消耗了 q mol D,即叙述的都是 v( 逆) 不一定平衡压强①其它条件一定、总压强一定,且m + n ≠ p + q平衡②其它条件一定、总压强一定,且m + n = p + q不一定平衡混合气体的平均相对分子质量①平均相对分子质量一定,且m + n ≠ p + q...