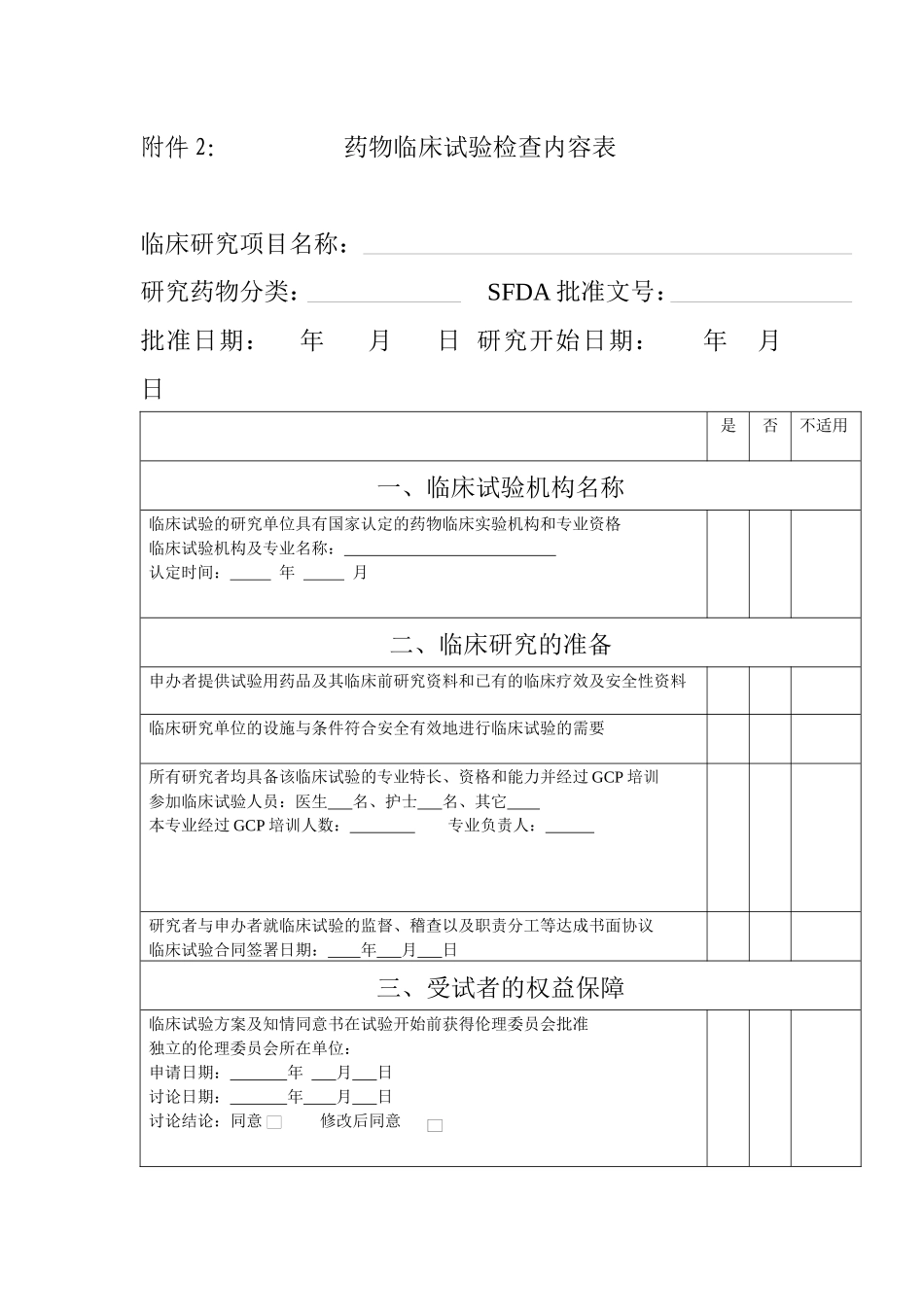
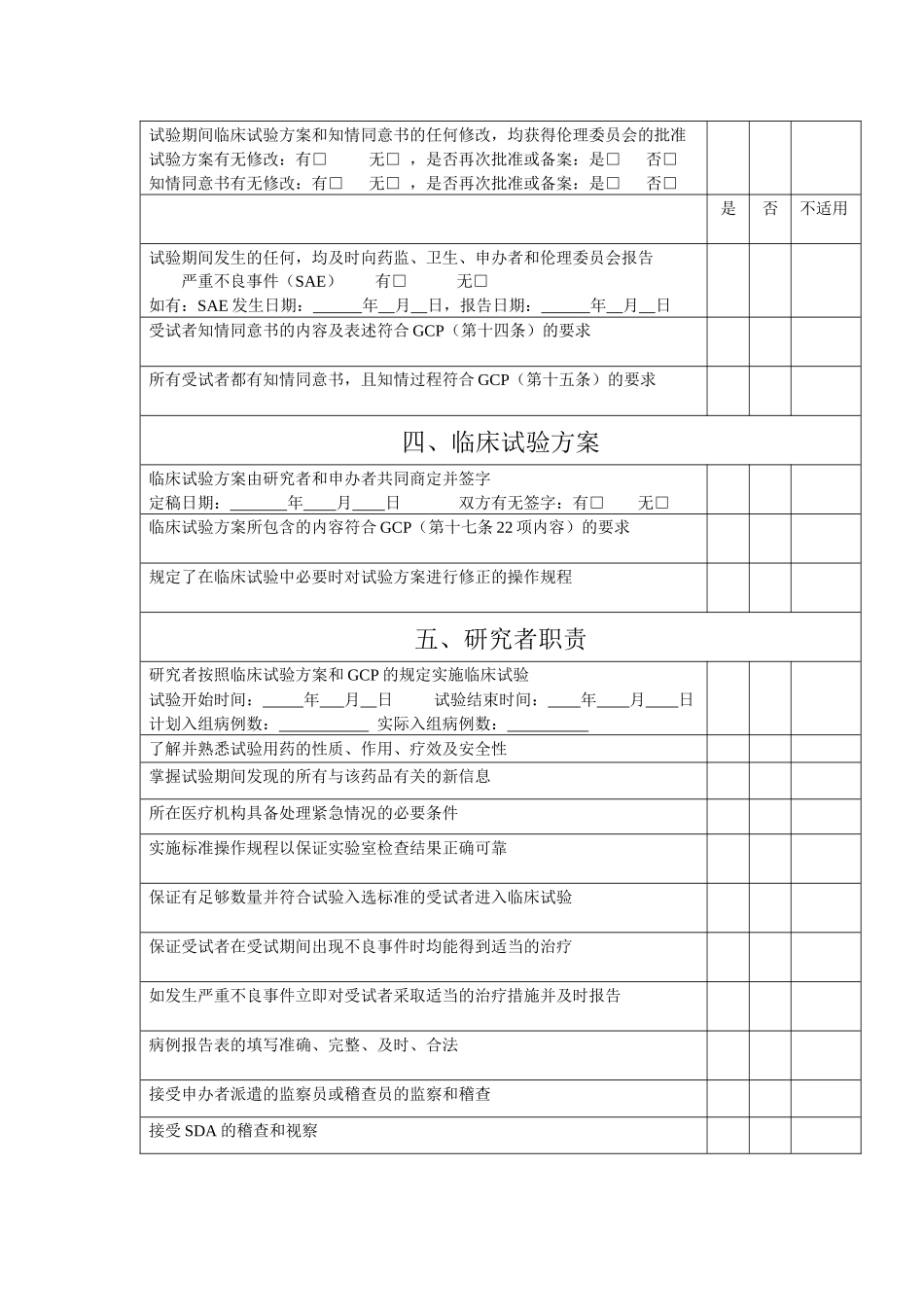
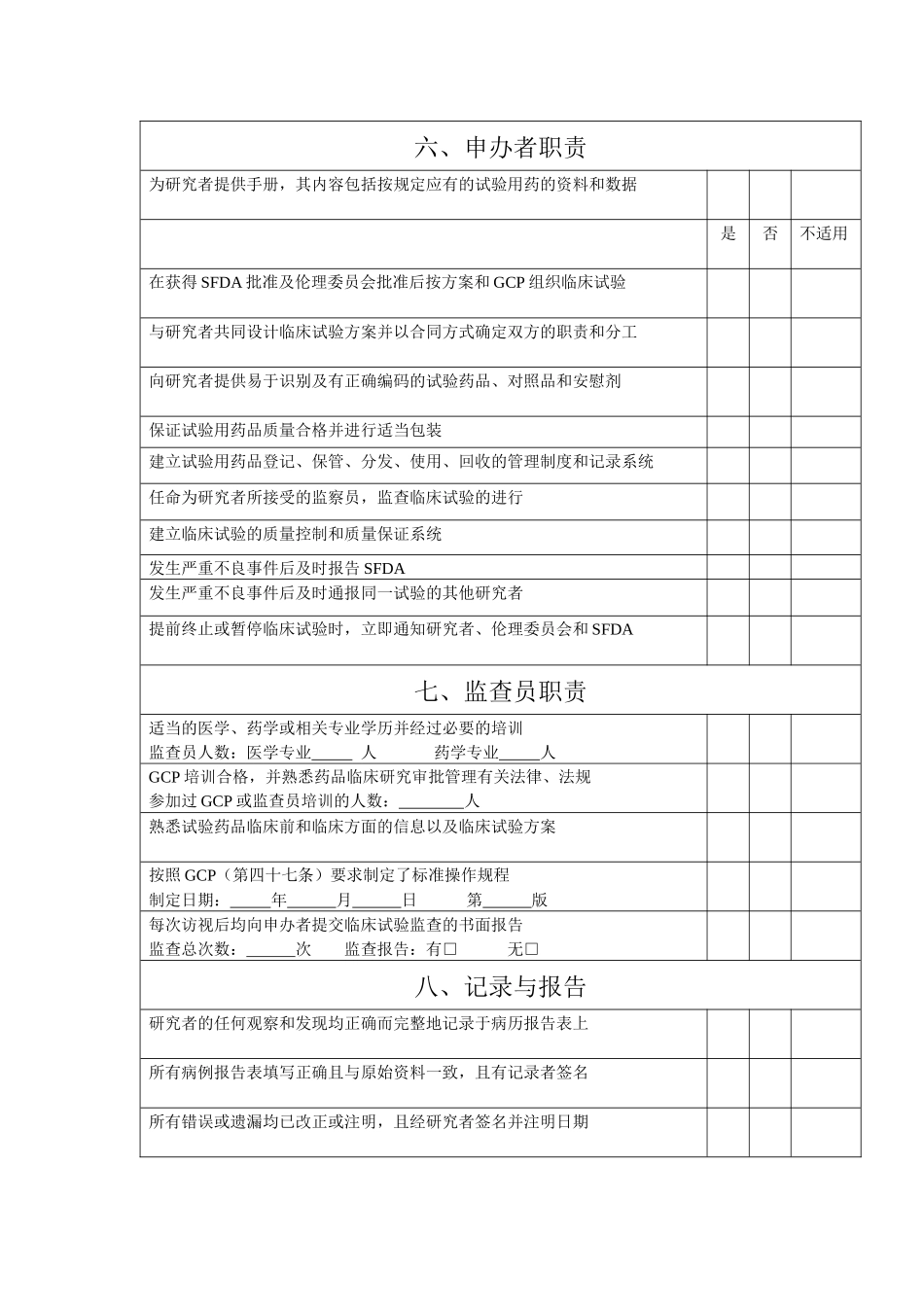
附件 2: 药物临床试验检查内容表临床研究项目名称:研究药物分类: SFDA 批准文号:批准日期: 年 月 日 研究开始日期: 年 月 日是否不适用一、临床试验机构名称临床试验的研究单位具有国家认定的药物临床实验机构和专业资格临床试验机构及专业名称: 认定时间: 年 月二、临床研究的准备申办者提供试验用药品及其临床前研究资料和已有的临床疗效及安全性资料临床研究单位的设施与条件符合安全有效地进行临床试验的需要所有研究者均具备该临床试验的专业特长、资格和能力并经过 GCP 培训参加临床试验人员:医生 名、护士 名、其它 本专业经过 GCP 培训人数: 专业负责人: 研究者与申办者就临床试验的监督、稽查以及职责分工等达成书面协议临床试验合同签署日期: 年 月 日三、受试者的权益保障临床试验方案及知情同意书在试验开始前获得伦理委员会批准独立的伦理委员会所在单位:申请日期: 年 月 日讨论日期: 年 月 日讨论结论:同意 修改后同意 试验期间临床试验方案和知情同意书的任何修改,均获得伦理委员会的批准试验方案有无修改:有□ 无□ ,是否再次批准或备案:是□ 否□知情同意书有无修改:有□ 无□ ,是否再次批准或备案:是□ 否□是否不适用试验期间发生的任何,均及时向药监、卫生、申办者和伦理委员会报告严重不良事件(SAE) 有□ 无□如有:SAE 发生日期: 年 月 日,报告日期: 年 月 日受试者知情同意书的内容及表述符合 GCP(第十四条)的要求所有受试者都有知情同意书,且知情过程符合 GCP(第十五条)的要求四、临床试验方案临床试验方案由研究者和申办者共同商定并签字定稿日期: 年 月 日 双方有无签字:有□ 无□临床试验方案所包含的内容符合 GCP(第十七条 22 项内容)的要求规定了在临床试验中必要时对试验方案进行修正的操作规程五、研究者职责研究者按照临床试验方案和 GCP 的规定实施临床试验试验开始时间: 年 月 日 试验结束时间: 年 月 日计划入组病例数: 实际入组病例数: 了解并熟悉试验用药的性质、作用、疗效及安全性掌握试验期间发现的所有与该药品有关的新信息所在医疗机构具备处理紧急情况的必要条件实施标准操作规程以保证实验室检查结果正确可靠保证有足够数量并符合试验入选标准的受试者进入临床试验保证受试者在受试期间出现不良事件时均能得到适当的治疗如发生严重不良事件立即对受试者采取适当的治疗措施并及时报...