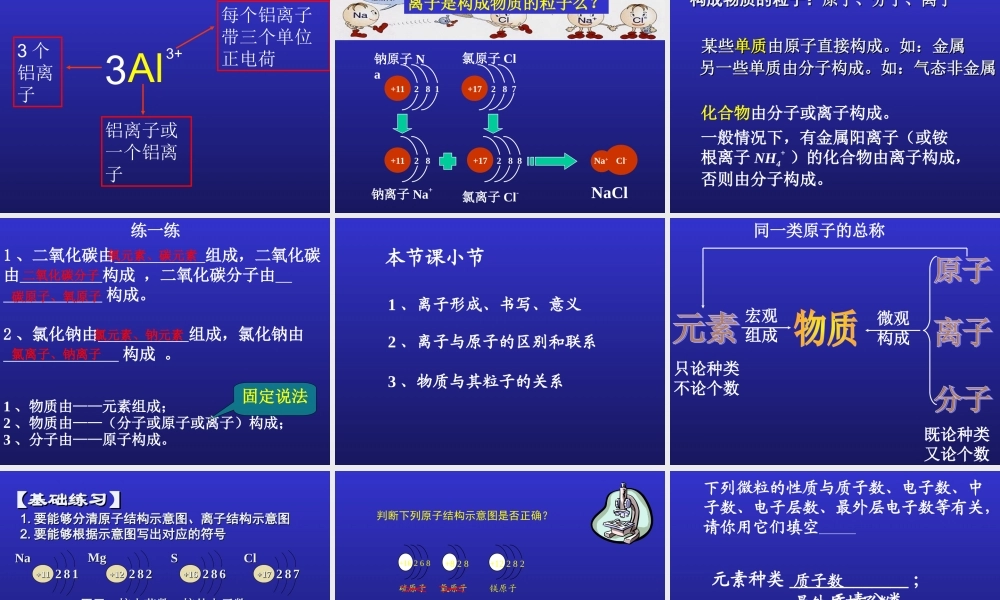
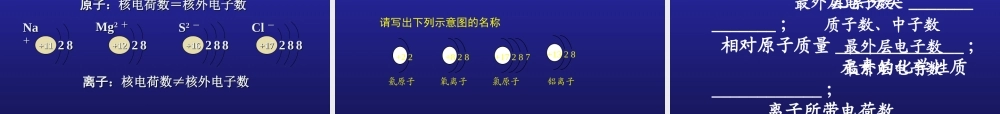
二、离子的形成渝高中学 渝高中学 李蒙李蒙 知识回顾知识回顾一、核外电子的排布一、核外电子的排布一、核外电子的排布一、核外电子的排布电子层离核由近到远,能量由低到高;共有七层。排布特点排布特点 11 :电子在核外是:电子在核外是分层排布分层排布的。的。排布特点排布特点 22 : 第一层最多排: 第一层最多排 22 个电子,个电子,第二层最多排第二层最多排 88 个电子,个电子,最外层电子数最多不超过最外层电子数最多不超过 88 个。个。电子总是先排在能量最低的电子层里(即第一层排满了才排第二层,依次下去) ⑴ 弧线表示电子层,⑵ “2” 表示第一层上排有两个电子。⑶“6” 表示第二层上排有 6 个电子。⑷ 表示原子核内有 8 个质子 。+ 82 、表示意义: 以氧原子结构示意为例二、原子结构示意图二、原子结构示意图1 、画法:圆圈标核电,电子分弧线, 数字一条线 。 1-181-18 号元素的原子结构示意号元素的原子结构示意图图氢 (H) 氦 (He) 锂 (Li) 铍 (Be) 硼 (B) 碳 (C) 氮 (N) 氧 (O) 氟 (F) 氖 (Ne )钠 (Na) 镁 (Mg) 铝 (Al) 硅 (Si) 磷 (P) 硫 (S) 氯 (Cl) 氩 (Ar) 原子结构与元素性质的关系原子结构与元素性质的关系元素分类最外层电子数 得失电子趋势化学性质金属元素非金属元素稀有气体元素一般小于 4易失去电子一般大于 3易得到电子等于 8 (氦 =2 )难于得失电子(为稳定结构)元素的化学性质,与它的原子的最外层电子数目有着密切的关系。易发生 化学反应极难发生化学反应 由于金属元素、非金属元素的原子核外最外层没有达到稳定结构,在化学反应中容易得失电子,从而达到稳定结构,那么,得失电子的结果怎样呢? 举例分析:NaNa221188+11+1122 88+11+11易失 1 个电子带 1 个正电荷钠离子223388+13+13AlAl易失 3 个电子带 3 个正电荷22 88+13+13铝离子226688+16+16SS易得 2 个电子带 2 个负电荷228888+16+16硫离子227788+17+17ClCl易得 1 个电子228888+17+17带 1 个负电荷氯离子金属阳离子比对应的金属原子核外电子层少一层非金属阴离子和对应的非金属原子核外电子层相同 离子——带电荷的原子或原子团。离子——带电荷的原子或原子团。阴离子阴离子:带负电荷的离子叫做阴离子。:带负电荷的离子叫做阴离子。 如: 如: OH- 、、 SO42- 、、 SS22 --、、 ClCl - - 阳离子阳离子:带正电荷的...