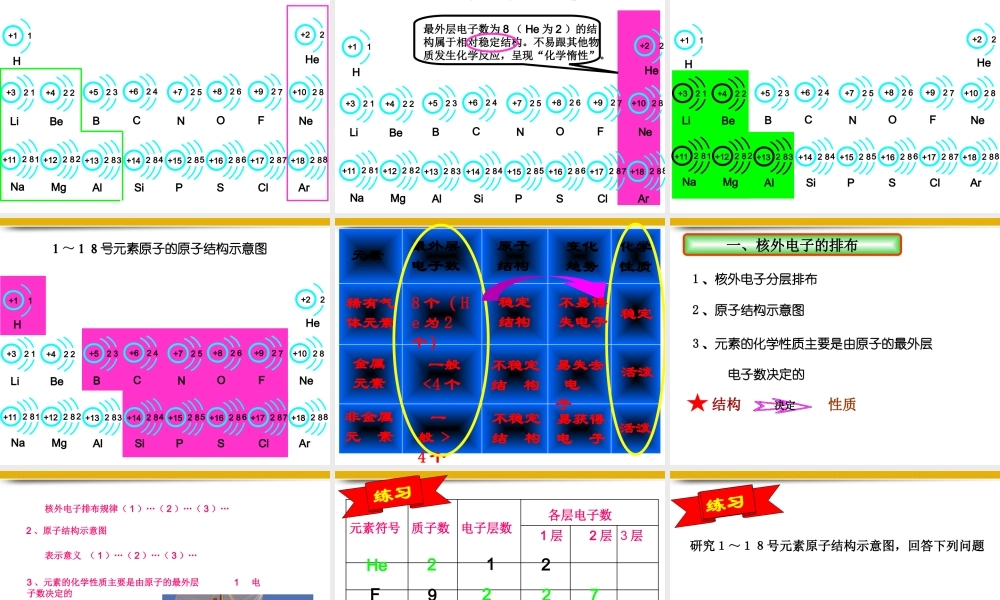
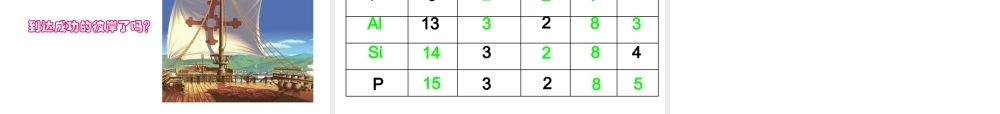
课题三 离 子• 第一课时 知识与能力目标: 1 .知道原子核外电子是分层排布的。 2 .知道原子结构示意图的意义 3 .理解原子最外层电子数与元素化学性质的关系。过程与方法目标:1 .能发现、提出、解决问题,同时拓展其空间想象力。 2 .观察原子结构示意图,归纳其最外层电子数与元素化学性质的关系。 情感态度与价值观目标: 1 .通过查阅相关网站,激发学生的好奇心和求知欲。 2 .树立“结构决定性质”的辨证唯物主义观点。教学重点:核外电子的排布;分析出原子最外层电子数与元 素化学性质的关系。教学难点:核外电子运动的特点;学生能形成“观察 -- 分析—归纳”的学习方法。上 节 知 识 回 顾原子核外有很大的空间 , 电子在核外做高速的运动。原 子质子 中子核外电子 原子核(+)(-)怎么排? 原子核外的电子是怎样排布的 ?1 、核外电子分层排布1234里外外一、核外电子的排布低低高高1122 33447 6 55 6 7…最里层最外层次外层能量核外电子排布规律能量最低各层最大容量1 、核外电子分层排布一、核外电子的排布最外层最外层最多排 8 个电子优先排在能量低的电子层里(由里向外)。第一层最多排2个,第二层最多排8个。( 第一层就是最外层最多 2 个 ) 。元素符号质子数电子层数1 层2 层3 层CNaCl6111723324182782练习各层电子数2 、原子结构示意图1 、核外电子分层排布一、核外电子的排布表示意义⑴ 弧线表示电子层 “⑵ 2” 、 “ 6” 表示第一、二层上排有的电子数。⑶ 表示原子核内有 8 个带正电荷的质子+ 826练习画出氮、氟、铝、硫、氩原子的原子结构示意图52+7N72+9F+13 2 83Al+16 2 8 6S+18 2 88Ar1+1H2+2He12+3Li32+5B42+6C52+7N22+4Be62+8O82+10Ne72+9F+18 2 88Ar+17 2 87Cl+16 2 8 6S+15 2 85P+14 2 84Si+13 2 83Al+12 2 8 2Mg+11 2 81Na1~18号元素原子的原子结构示意图1~18号元素原子的原子结构示意图最外层电子数为 8 ( He 为 2 )的结构属于相对稳定结构。不易跟其他物质发生化学反应,呈现“化学惰性”。1+1H2+2He12+3Li32+5B42+6C52+7N22+4Be62+8O82+10Ne72+9F+18 2 88Ar+17 2 87Cl+16 2 8 6S+15 2 85P+14 2 84Si+13 2 83Al+12 2 8 2Mg+11 2 81Na1~18号元素原子的原子结构示意图1+1H2+2He12+3Li32+5B42+6C52+7N22+4Be62+8O82+10Ne72+9F+18 2 88Ar+17 2 87Cl+16 2 8 6S+15 2 85P+1...