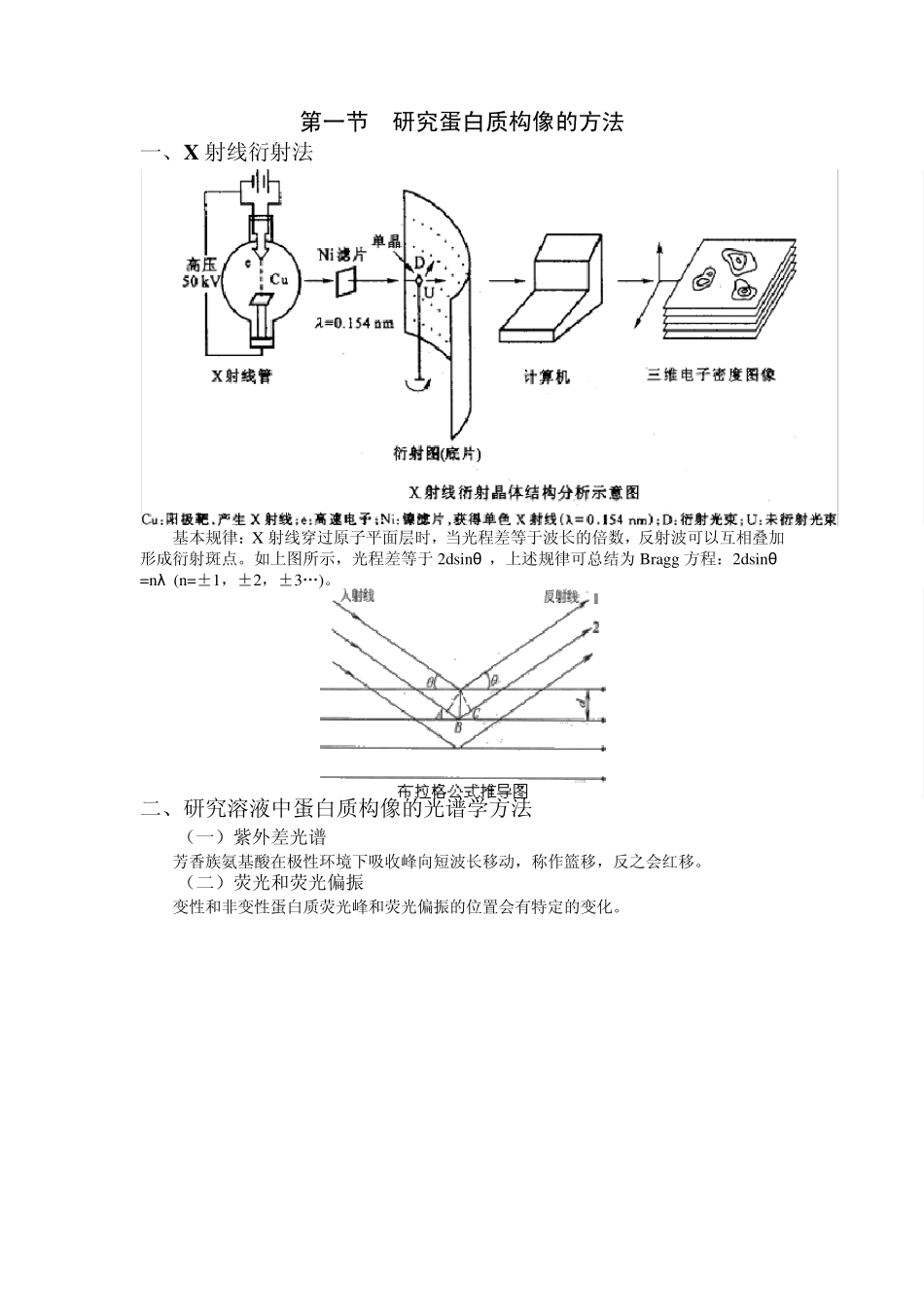
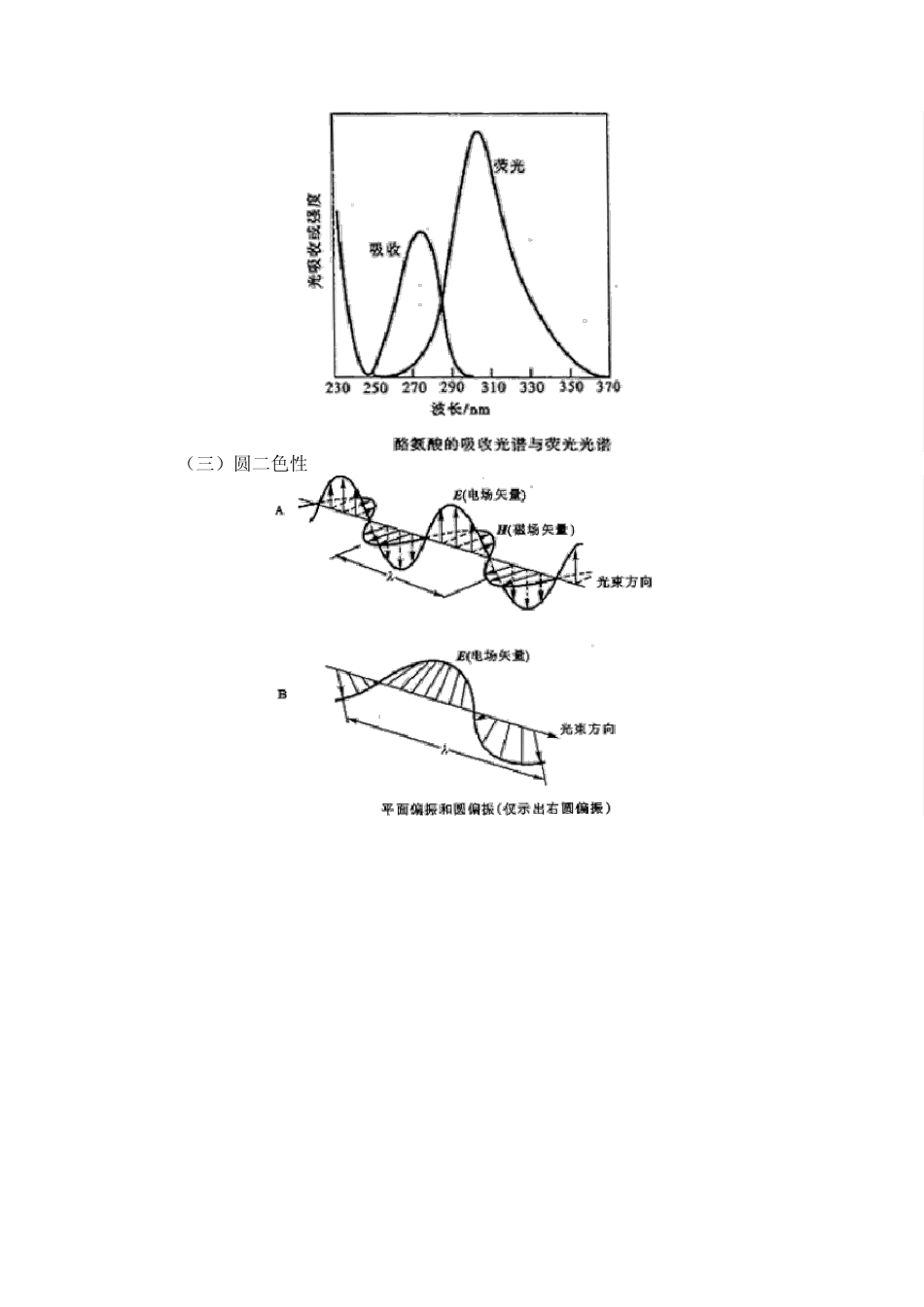
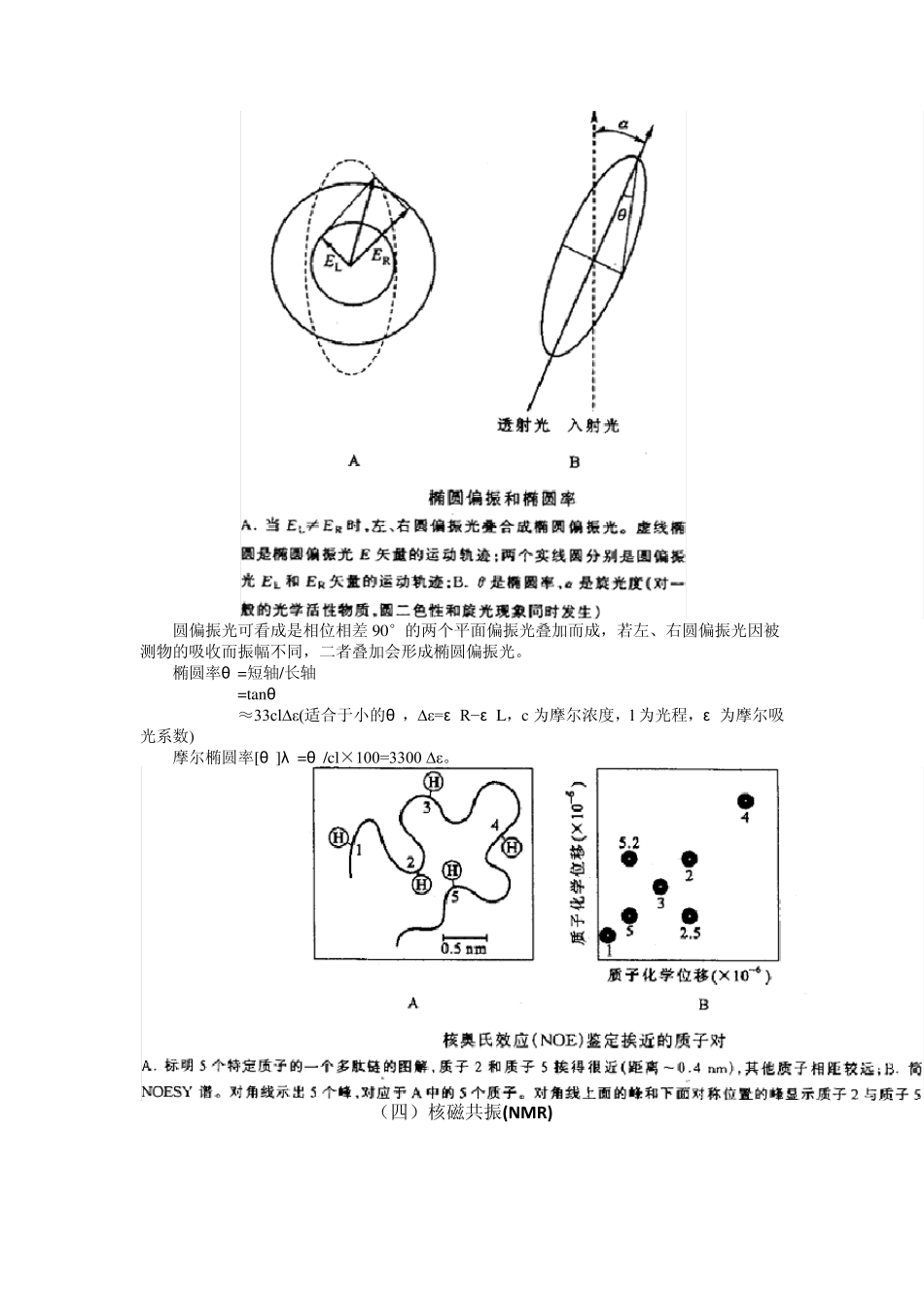
第一节 研究蛋白质构像的方法 一、X 射线衍射法 基本规律:X 射线穿过原子平面层时,当光程差等于波长的倍数,反射波可以互相叠加形成衍射斑点。如上图所示,光程差等于2dsinθ ,上述规律可总结为Bragg 方程:2dsinθ=nλ (n=±1,±2,±3…)。 二、研究溶液中蛋白质构像的光谱学方法 (一)紫外差光谱 芳香族氨基酸在极性环境下吸收峰向短波长移动,称作篮移,反之会红移。 (二)荧光和荧光偏振 变性和非变性蛋白质荧光峰和荧光偏振的位置会有特定的变化。 (三)圆二色性 圆偏振光可看成是相位相差90°的两个平面偏振光叠加而成,若左、右圆偏振光因被测物的吸收而振幅不同,二者叠加会形成椭圆偏振光。 椭圆率θ =短轴/长轴 =tanθ ≈33cl∆ε(适合于小的θ ,∆ε=ε R−ε L,c 为摩尔浓度,l 为光程,ε 为摩尔吸光系数) 摩尔椭圆率[θ ]λ =θ /cl×100=3300 ∆ε。 (四)核磁共振(NMR) 第二节 稳定蛋白质三维结构的作用力 一、氢键 二、范德华力 定向效应 诱导效应 分散效应 三、疏水作用(熵效应) 四、盐键 五、二硫键 第三节 多肽主链折叠的空间限制 一、酰胺平面与α -碳原子的二面角(φ 和ψ ) 规定键两侧基团为顺式排列时为 0o,从 C 沿键轴方向观察,顺时针旋转的角度为正值。 二、可允许的φ 和ψ :拉氏构像图 二、可允许的φ 和ψ 值:拉氏构像图 第四节 二级结构:多肽链折叠的规则方式 一、α 螺旋 (一)α 螺旋的结构 多肽链中的各个肽平面围绕同一轴旋转,形成螺旋结构,螺旋一周,沿轴上升的距离即螺距为 0.54nm,含 3.6 个氨基酸残基;两个氨基酸之间的距离为 0.15nm。 肽链内形成氢键,氢键的取向几乎与轴平行,每一个氨基酸残基的酰胺基团的-NH 基与其后第四个氨基酸残基酰胺基团的-CO 基形成氢键。 蛋白质分子为右手 a-螺旋。 (二)α 螺旋的偶极矩和帽化 (三)α 螺旋的手性 (四)影响α 螺旋形成的因素 R 基太小使键角自由度过大,带同种电荷的R 基相互靠近,β 碳原子上有分支均不利于形成α 螺旋,含脯氨酸的肽段不能形成α 螺旋。 (五)其他类型的螺旋 b-折叠有两种类型。一种为平行式,即所有肽链的N-端都在同一边。另一种为反平行式,即相邻两条肽链的方向相反。 二、β 折叠片 b-折叠是由两条或多条几乎完全伸展的肽链平行排列,通过链间的氢键交联而形成的。肽链的主链呈锯齿桩折叠构像。两个氨基酸之...