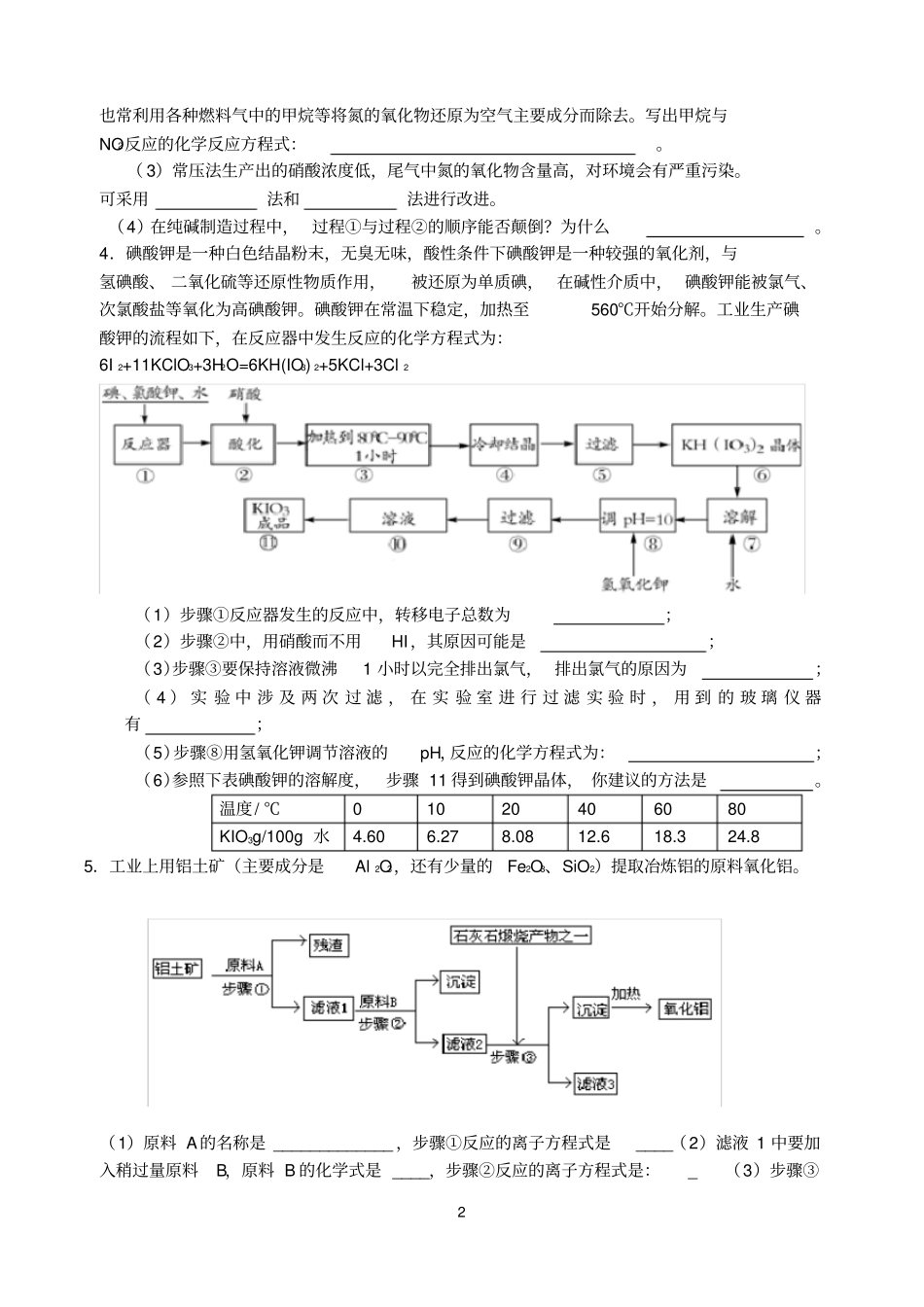
1 2.下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用 98.3%的浓硫酸吸收三氧化硫。(1)写出工业上用FeS2 制取 SO2的化学方程式。(2)写出上图中部分装置的作用:甲:①混合SO2和 O2;②;丙和丁:。(3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾;②( 4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于;丙和丁相当于。( 5)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率 D .三氧化硫用98.3%的浓硫酸吸收, 目的是防止形成酸雾,以提高三氧化硫的吸收效率3.氨在国民经济中占有重要的地位。现在约有 80%的氨用来制造化肥,其余的用作生产其他化工产品的原料。例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法。( 1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:设备 A 的名称是,设备 B的名称是。( 2)硝酸厂的尾气中含有NO和 NO2 等污染物, 籽了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:Na2CO3+2NO2====NaNO2+NaNO3+CO2 但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,2 也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去。写出甲烷与NO2反应的化学反应方程式:。( 3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染。可采用法和法进行改进。(4)在纯碱制造过程中, 过程①与过程②的顺序能否颠倒?为什么。4.碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、 二氧化硫等还原性物质作用,被还原为单质碘, 在碱性介质中, 碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生...