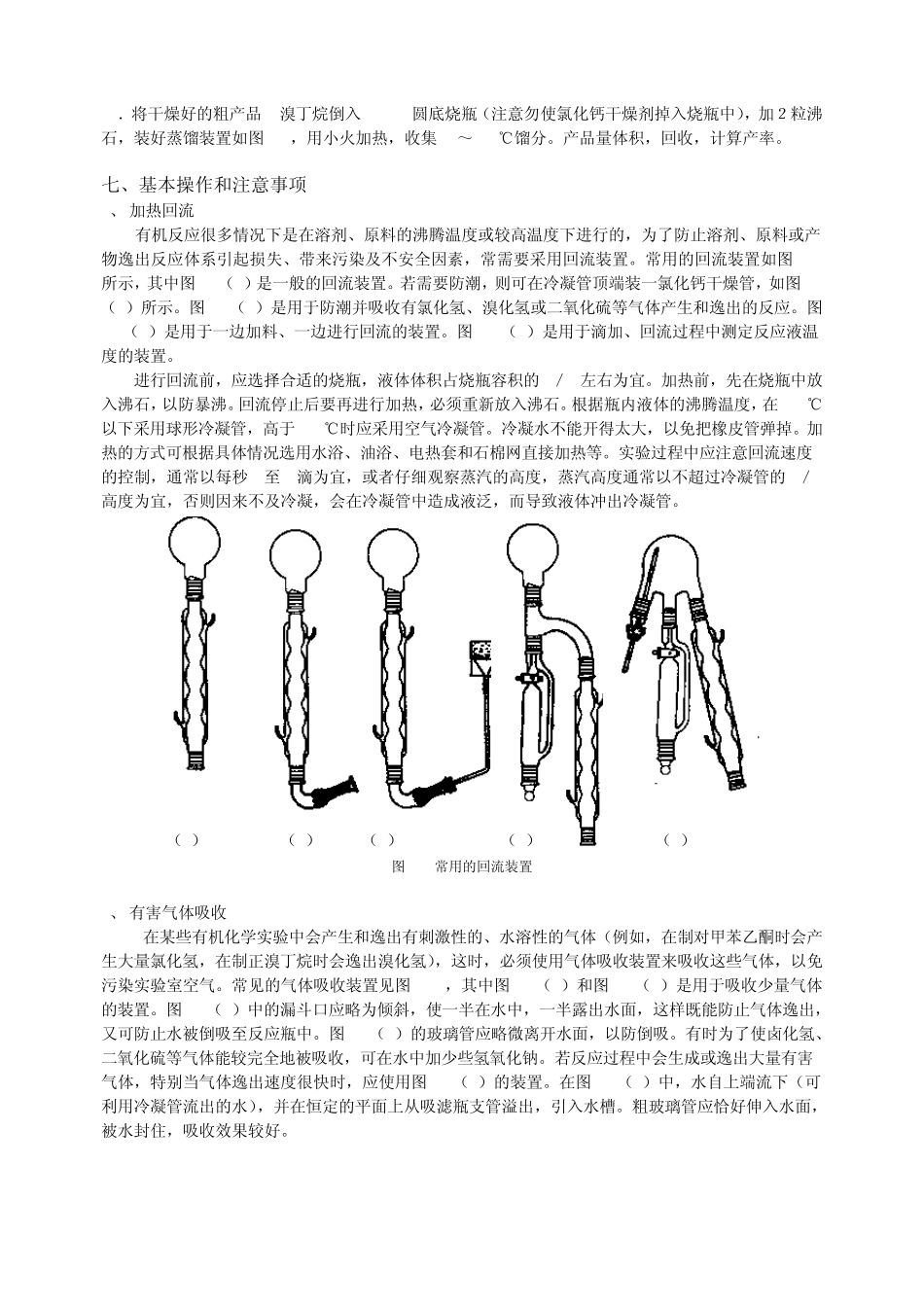
实验三 1-溴丁烷的制备一、实验目的1.学习由醇制备溴代烃的原理及方法。2.练习回流及有害气体吸收装置的安装与操作。3.进一步练习液体产品的纯化方法 — —洗涤、干燥、蒸馏等操作。二、实验原理NaBr + H2SO4HBr + NaHSO4C4H9OH + HBrC4H9Br + H2O C4H9OHC2H5CH CH2+ H2OC4H9OH+ H2O2C4H9OC4H9HBr + H2SO4Br2 + SO2 + H2OH2SO4H2SO4本实验主反应为可逆反应,为了提高产率一方面采用 HBr过量;另一方面使用 NaBr和 H2SO4代替 HBr,使 HBr边生成边参与反应,这样可提高 HBr的利用率,同时 H2SO4还起到催化脱水作用。反应中,为防止反应物正丁醇及产物 1-溴丁烷逸出反应体系,反应采用回流装置。由于 HBr有毒害且HBr气体难以冷凝,为防止 HBr逸出,污染环境,需安装气体吸收装置。回流后再进行粗蒸馏,一方面使生成的产品 1-溴丁烷分离出来,便于后面的分离提纯操作;另一方面,粗蒸过程可进一步使醇与HBr的反应趋于完全。粗产品中含有未反应的醇和副反应生成的醚,用浓H2SO4洗涤可将它们除去。因为二者能与浓H2SO4形成佯盐: + H2SO4C4H9OH +C4H9OC4H9H2SO4C4H9OH2 HSO4C4H9OC4H9HHSO4如果1-溴丁烷中含有正丁醇,蒸馏时会形成沸点较低的前馏分(1-溴丁烷和正丁醇的共沸混合物沸点为 98.6℃,含 1-溴丁烷 87%,正丁醇 13%),而导致精制品产率降低。三、实验药品及物理常数药品名称分子量(molwt)用量(mL、g、mol)熔点(℃)沸点(℃)比重(d420)水溶解度(g/100mL)正丁醇74.126.2mL(0.068mol)117.70.8098 7.91-溴丁烷137.03101.61.276不溶于水溴化钠102.898.3(0.08mol)77.10.9005微溶于水浓硫酸9810+3mL1.84 易溶于水其它药品10%碳酸钠溶液、无水氯化钙四、实验装置图制备1-溴丁烷的实验装置如图4-1~4-2所示。五、实验流程图6.2ml正丁醇8.3g NaBr加样品10ml H2O10ml H2SO4配混酸分 四次回流反应30min.蒸出粗产品水洗浓硫酸洗涤碱洗加NaHSO3除Br2水洗分去水层干燥蒸馏收集99-102度产品称重,计算产率。CaCl22粒沸石六、实验步骤1.配制稀硫酸。在烧杯中加入 10 mL 水,将 10 mL 浓硫酸分批加入水中,并振摇。用冷水浴冷却,备用。2.在 100 mL圆底烧瓶中依次加入 NaBr 8.3g,正丁醇6.2mL,沸石 2 粒,摇匀。3.安装带气体吸收的回流装置如图4-1,取一温度计套管及一长颈玻璃漏斗,用橡皮管将温度计套管及长颈玻璃漏斗相连,温度计套管装在球形冷凝管上口,长颈玻璃漏斗倒置在一盛...