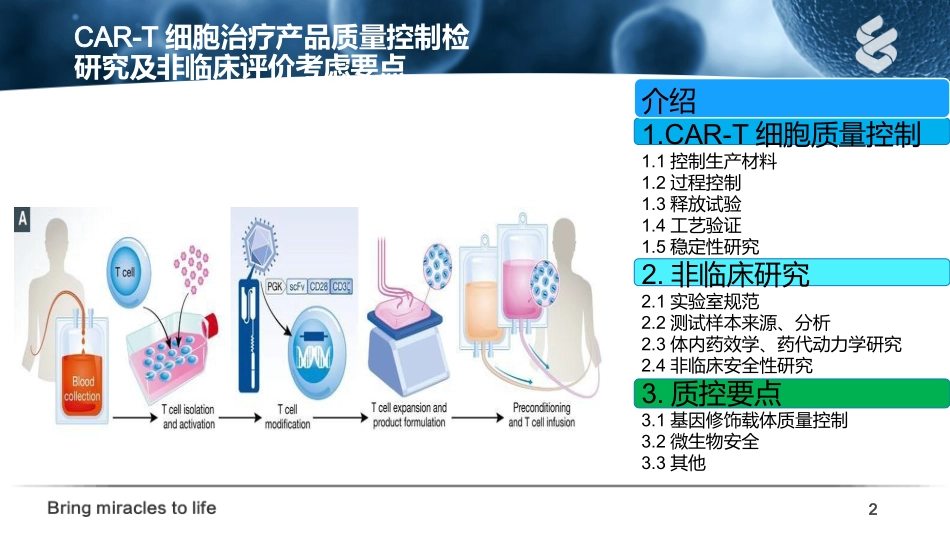
Presenter:LiuZhengjunDate:09/17/2019CAR-T细胞治疗产品质量控制检研究及非临床评价考虑要点———Lentivirus2CAR-T细胞治疗产品质量控制检研究及非临床评价考虑要点介绍1.CAR-T细胞质量控制1.1控制生产材料1.2过程控制1.3释放试验1.4工艺验证1.5稳定性研究2.非临床研究2.1实验室规范2.2测试样本来源、分析2.3体内药效学、药代动力学研究2.4非临床安全性研究3.质控要点3.1基因修饰载体质量控制3.2微生物安全3.3其他•嵌合抗原受体T细胞(CAR-T,ChimericantigenreceptorTcell)是指通过基因修饰技术,将带有特异性抗原识别结构域及T细胞激活信号的遗传物质转入T细胞,使T细胞通过直接与肿瘤细胞表面的特异性抗原相结合而激活,通过释放穿孔素、颗粒酶素B等直接杀伤肿瘤细胞,同时还通过释放细胞因子募集人体内源性免疫细胞杀伤肿瘤细胞,从而达到治疗肿瘤的目的,而且还可形成免疫记忆T细胞从而获得特异性的抗肿瘤长效机制。目前,CAR-T细胞对多种血液肿瘤显示了非常好的临床效果,对实体瘤治疗也表现出了非常大的潜力。CAR通常含有三个结构域:识别肿瘤相关抗原的细胞外结构域(例如,单链片段可变(scFv));一个信号转导结构域(例如,CD3ζ);和细胞内共刺激结构域(例如,可衍生自CD28,4-1BB,OX40,等)。3介绍4嵌合抗原受体(CAR)的结构CAR的结构分为三部分:1.抗原结合区,通常为scFv,用来结合肿瘤细胞上的抗原;2.跨膜区,用来向细胞内传递结合信号;3.胞内信号区,用来激活T细胞,发挥生物学功能。5嵌合抗原受体(CAR)的结构6慢病毒载体的生产-1以研发为目的的,采用生长在培养皿、培养瓶、多盘系统的贴壁细胞。转染试剂采用磷酸钙、PEI、阳离子转染试剂。小规模生产慢病毒载体大规模生产慢病毒贴壁细胞大规模生产慢病毒悬浮培养生产慢病毒7慢病毒载体的生产-2目标转向临床实验或产业化,可以通过扩展方法(增加生产单元),也可以通过采用悬浮培养系统实现。贴壁细胞大规模生产慢病毒小规模生产的直接放大,即通过增加培养/生产单元来实现。生产基本上采用大量的多层培养系统。如:10层细胞工厂在悬浮培养模式下,细胞可以通过不同的容器进行扩大:摇瓶、玻璃生物反应器、不锈钢生物反应器、培养袋及一次性搅拌容器。通过大的生物反应器中培养细胞,主要用于工业化生产。悬浮生长,这使得细胞培养和扩大比贴壁培养更加容易,同时培养基无动物来源成分可降低外源物质污染风险。核酸酶转染试剂冷冻保护剂血清细胞培养基基因修饰的载体控制生产材料.•生产CAR-T细胞的每种物质,都应明确定义并评估其适用性。应测试成份,纯度,细菌内毒素,无菌,外来因子和生物活性,以证明质量,尽可能用简单的培养基,避免使用人或动物来源的成分,或可能引起过敏的药物。8CAR-T细胞质量控制-1.1控制生产材料核酸酶转染试剂冷冻保护剂血清细胞培养基基因修饰的载体控制生产材料.•培养过程中对培养基、活性因子等外源蛋白的要求-明确的来源及批号,应有质量检定合格报告•CAR-T细胞制剂制备所用的样本及物料-《生物制品生产用原材料及辅料质量控制规程》实行管理。物料供应商应有相应的资质,并提供证明文件。91.1控制生产材料3.3其他•生产病毒的起始原材料含有CAR基因的穿梭载体辅助质粒载体包装细胞10控制生产材料质粒菌种菌种库的建立细胞库的建立质粒应序列信息明确,并经过鉴定和确认。质粒菌种应采取种子库系统,并按照《中国药典》相关要求完成菌种库的检定。菌种建库过程应符合药品GMP规范,同时应有明确来源和批次信息,并有详细记录。质粒的质量应经过检测,包括但不限于:a)纯度:超螺旋型的含量,细菌基因组DNA、RNA和蛋白残留量;b)无菌试验;c)内毒素试验;d)酶切鉴定;e)基因测序;f)如工艺中使用有潜在危险性的物质,则需做物质残余量的测定。•制备质粒载体时,从工作种子批取一支或几支菌种复苏,逐级扩大培养后(培养过程中不应再使用抗生素等具有筛选压力的试剂)进行质粒提取,经纯化及除菌过滤后成为质粒批11质粒鉴别含量纯度(包括DNA形式及杂质)无菌内毒素等转染T细胞的质粒载体质粒的细胞转染效率质粒的质量控制No.StandardQCReleaseTestDescripti...