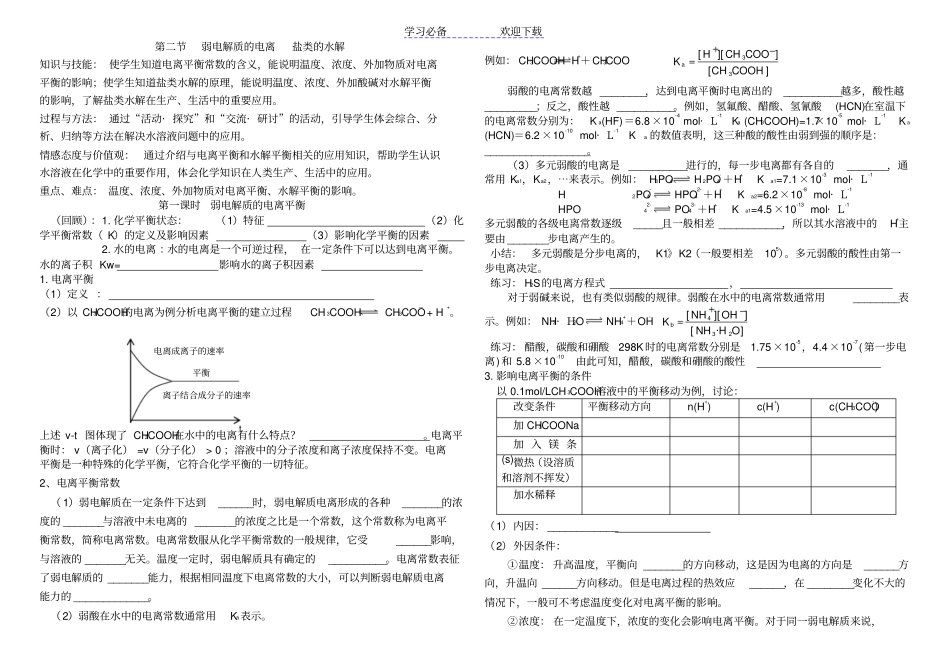
学习必备欢迎下载第二节弱电解质的电离盐类的水解知识与技能: 使学生知道电离平衡常数的含义,能说明温度、浓度、外加物质对电离平衡的影响;使学生知道盐类水解的原理,能说明温度、浓度、外加酸碱对水解平衡的影响,了解盐类水解在生产、生活中的重要应用。过程与方法: 通过“活动· 探究”和“交流· 研讨”的活动,引导学生体会综合、分析、归纳等方法在解决水溶液问题中的应用。情感态度与价值观:通过介绍与电离平衡和水解平衡相关的应用知识,帮助学生认识水溶液在化学中的重要作用,体会化学知识在人类生产、生活中的应用。重点、难点: 温度、浓度、外加物质对电离平衡、水解平衡的影响。第一课时弱电解质的电离平衡(回顾):1. 化学平衡状态:(1)特征(2)化学平衡常数( K)的定义及影响因素(3)影响化学平衡的因素2. 水的电离 :水的电离是一个可逆过程, 在一定条件下可以达到电离平衡。水的离子积 Kw= 影响水的离子积因素1. 电离平衡(1)定义 :(2)以 CH3COOH的电离为例分析电离平衡的建立过程 CH 3COOH CH3COO— + H+。上述 v-t 图体现了 CH3COOH在水中的电离有什么特点?。电离平衡时: v(离子化) =v(分子化) > 0 ;溶液中的分子浓度和离子浓度保持不变。电离平衡是一种特殊的化学平衡,它符合化学平衡的一切特征。2、电离平衡常数( 1)弱电解质在一定条件下达到______时,弱电解质电离形成的各种_______的浓度的 _______与溶液中未电离的 _______的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。电离常数服从化学平衡常数的一般规律,它受______影响,与溶液的 _______无关。温度一定时,弱电解质具有确定的__________。电离常数表征了弱电解质的 _______能力,根据相同温度下电离常数的大小,可以判断弱电解质电离能力的 _____________。(2)弱酸在水中的电离常数通常用Ka表示。例如: CH3COOH H++CH3COO-][]][[33COOHCHCOOCHHK a弱酸的电离常数越 ________,达到电离平衡时电离出的__________越多,酸性越_________;反之,酸性越 __________。例如,氢氟酸、醋酸、氢氰酸(HCN)在室温下的电离常数分别为: K a(HF)=6.8 ×10-4 mol· L-1 Ka (CH3COOH)=1.7×10-5 mol· L-1 K a(HCN)=6.2 ×10-10 mol· L-1 Ka 的数值表明,这三种酸的酸性由弱到强的顺序是:__________________。(3)多元弱酸的电离是__________进行的,每一步电离...