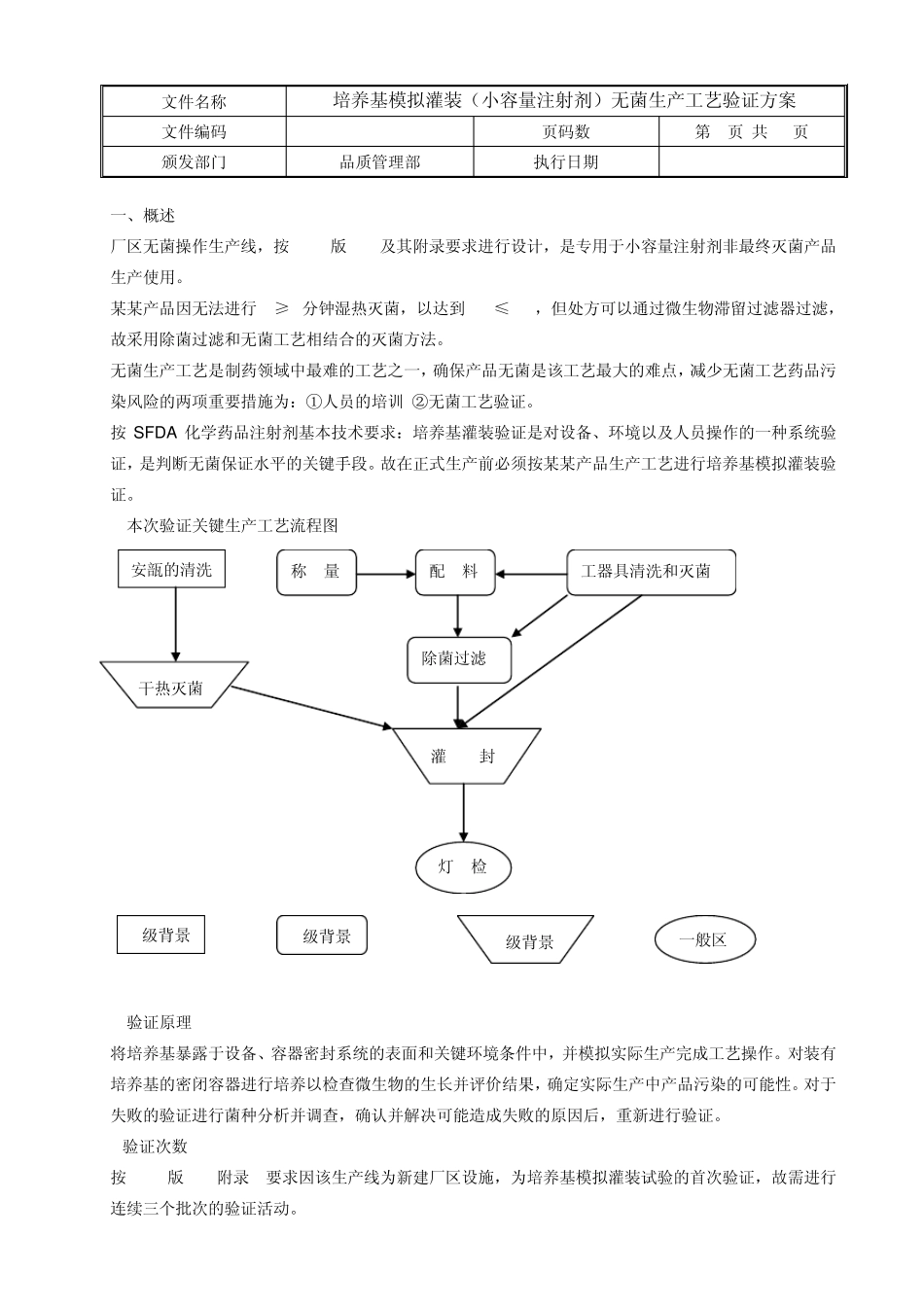
文件名称 培养基模拟灌装(小容量注射剂)无菌生产工艺验证方案 文件编码 页码数 第1页/共20页 颁发部门 品质管理部 执行日期 审 批 部门 姓名 签名 日期 起草人 品质管理部 起草人 生产技术部 起草人 针剂车间 审核人 针剂车间 审核人 生产技术部 审核人 质检中心 审核人 品质管理部 批准人 质量负责人 分发部门: 培养基模拟灌装(小容量注射剂)无菌生产工艺验证小组 文件名称 培养基模拟灌装(小容量注射剂)无菌生产工艺验证方案 文件编码 页码数 第2页/共20页 颁发部门 品质管理部 执行日期 一、概述 厂区无菌操作生产线,按2010版GMP及其附录要求进行设计,是专用于小容量注射剂非最终灭菌产品生产使用。 某某产品因无法进行F0≥8分钟湿热灭菌,以达到SAL≤10-6,但处方可以通过微生物滞留过滤器过滤,故采用除菌过滤和无菌工艺相结合的灭菌方法。 无菌生产工艺是制药领域中最难的工艺之一,确保产品无菌是该工艺最大的难点,减少无菌工艺药品污染风险的两项重要措施为:①人员的培训 ②无菌工艺验证。 按SFDA 化学药品注射剂基本技术要求:培养基灌装验证是对设备、环境以及人员操作的一种系统验证,是判断无菌保证水平的关键手段。故在正式生产前必须按某某产品生产工艺进行培养基模拟灌装验证。 1 本次验证关键生产工艺流程图 2 验证原理 将培养基暴露于设备、容器密封系统的表面和关键环境条件中,并模拟实际生产完成工艺操作。对装有培养基的密闭容器进行培养以检查微生物的生长并评价结果,确定实际生产中产品污染的可能性。对于失败的验证进行菌种分析并调查,确认并解决可能造成失败的原因后,重新进行验证。 3验证次数 按2010版GMP附录1要求因该生产线为新建厂区设施,为培养基模拟灌装试验的首次验证,故需进行连续三个批次的验证活动。 D级背景 C级背景 安瓿的清洗 干热灭菌 工器具清洗和灭菌 配 料 称 量 灯 检 灌 封 除菌过滤 A级背景 一般区 文件名称 培养基模拟灌装(小容量注射剂)无菌生产工艺验证方案 文件编码 页码数 第3页/共20页 颁发部门 品质管理部 执行日期 二、验证目的 1通过该工艺验证活动证明新设计厂房采用既定的无菌生产工艺能保证产品的无菌要求; 2通过该工艺验证活动证明无菌操作相关人员资格,降低人员带入无菌的风险; 3通过该工艺验证活动确保生产符合现行GMP法规要求。 三、验证范围和实施时间 1本验证方案适用...