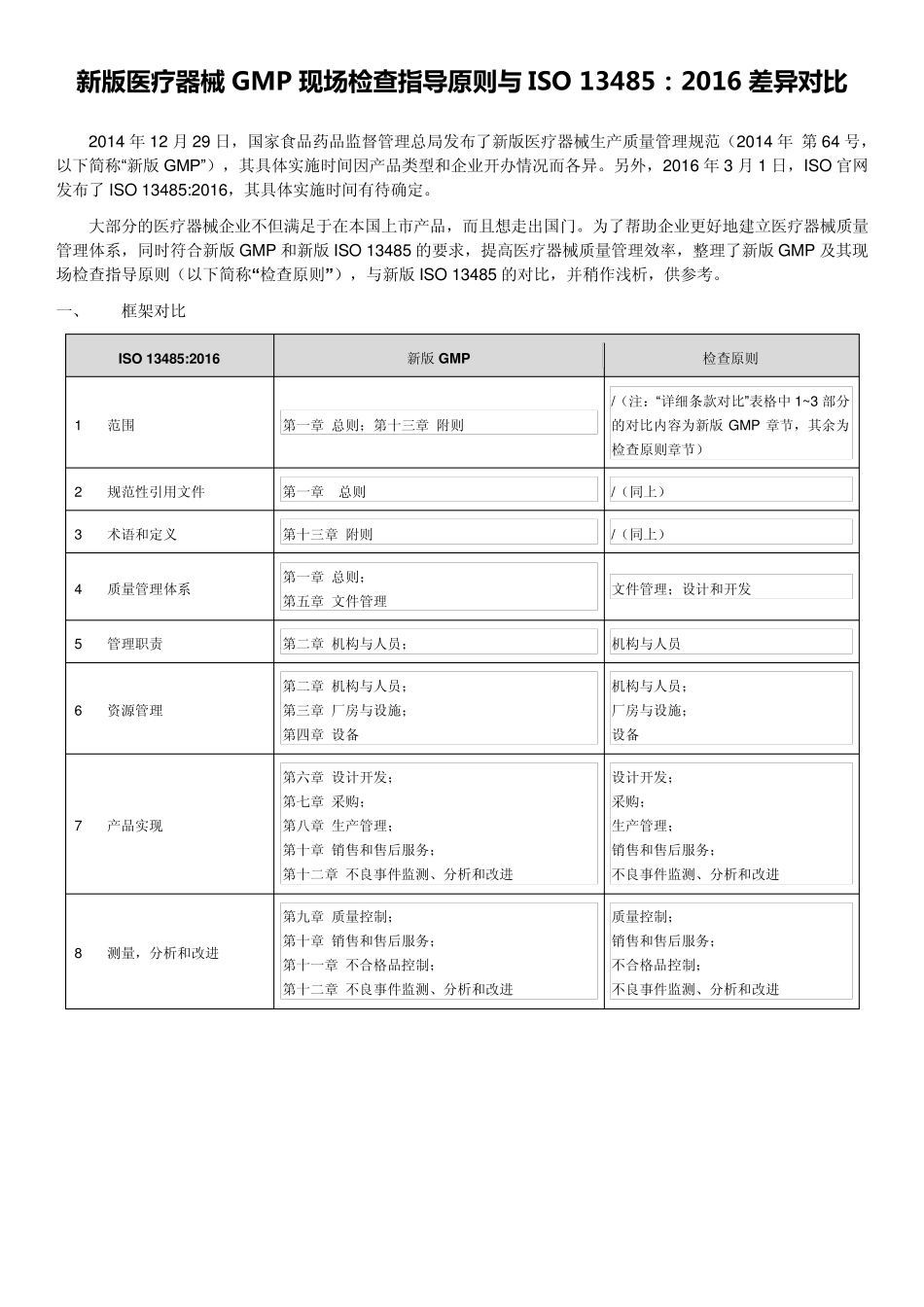
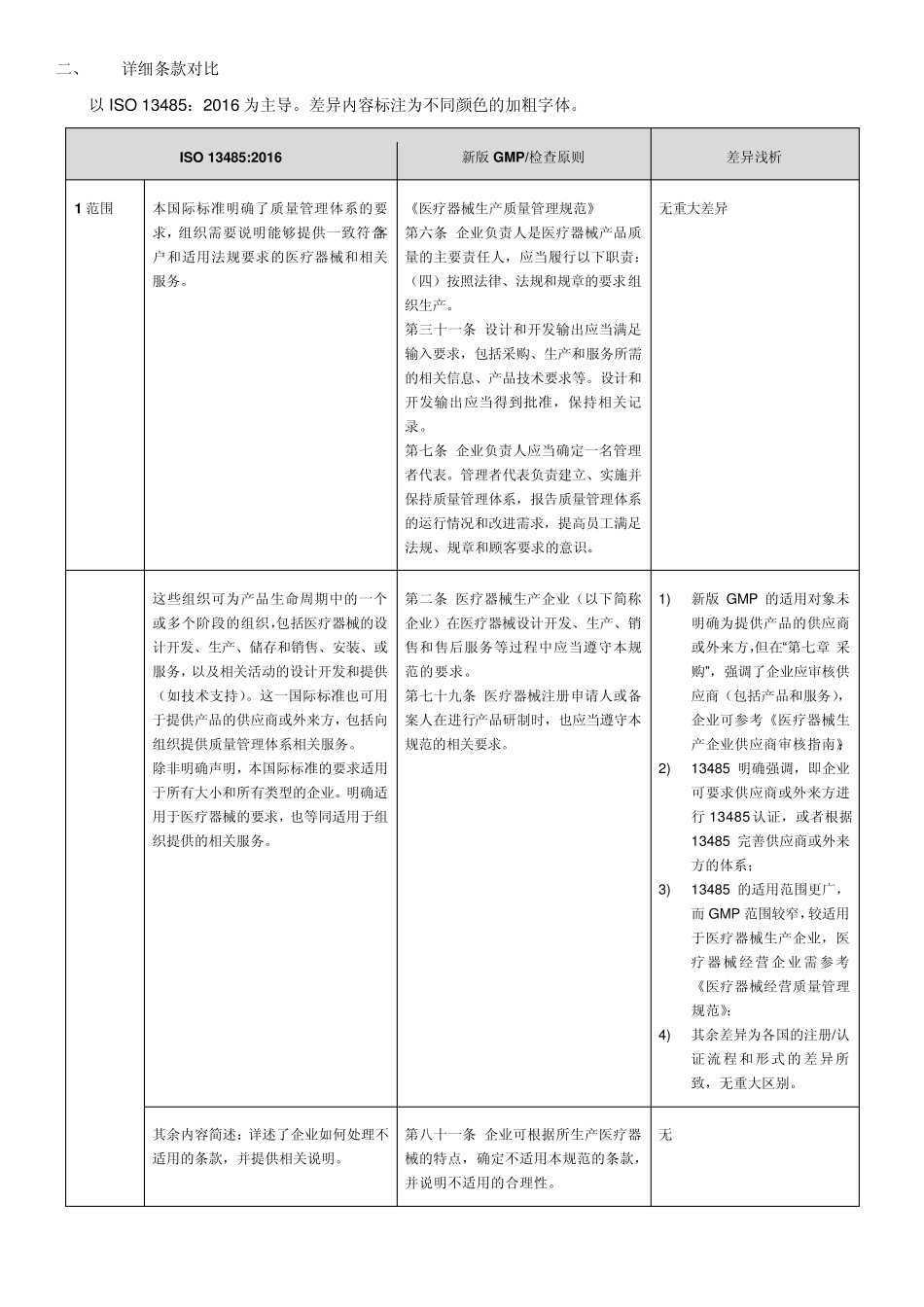
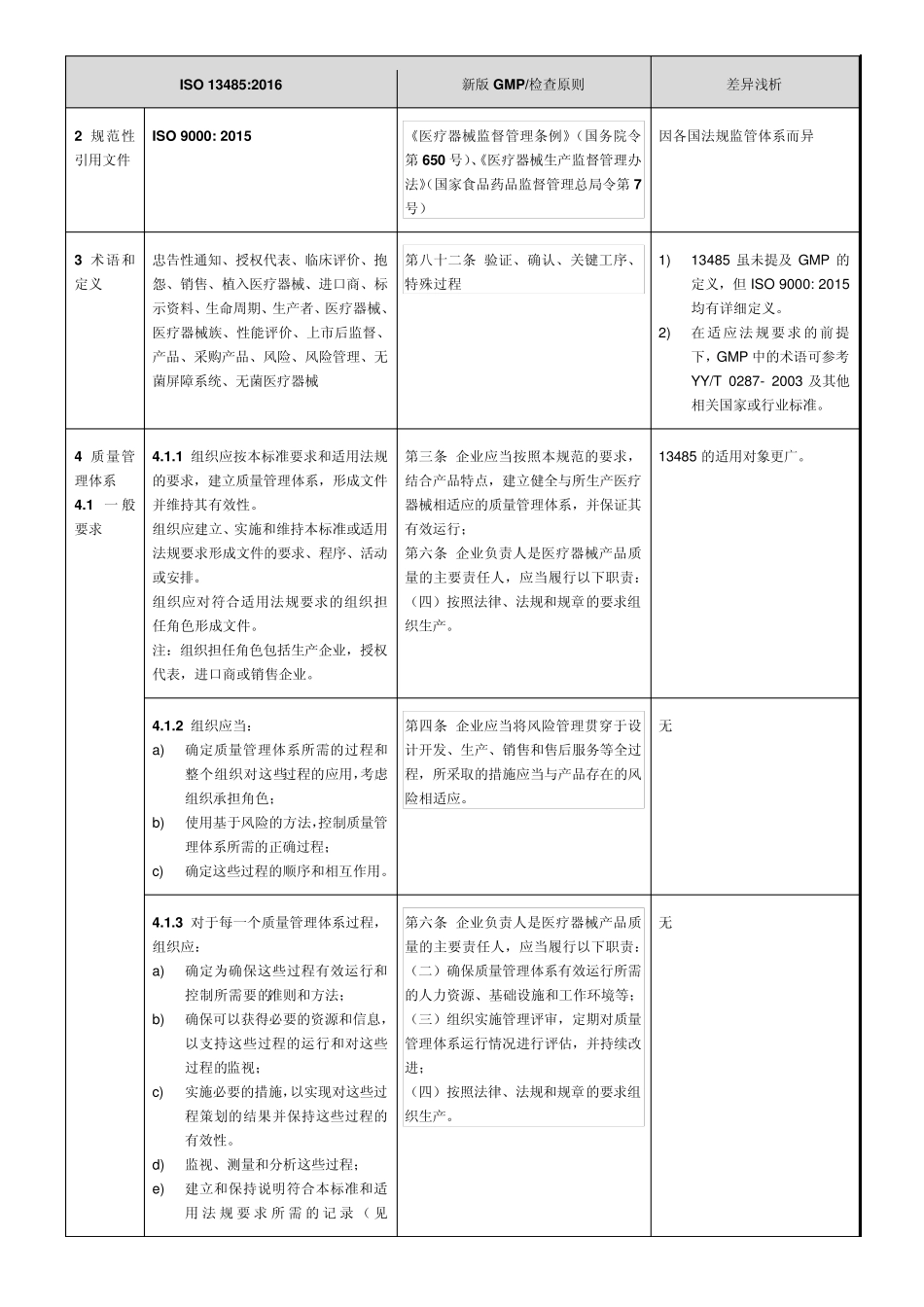
新 版 医 疗 器 械 GMP 现 场 检 查 指 导 原 则 与 ISO 13485:2016 差异对比 2014 年12 月29 日,国家食品药品监督管理总局发布了新版医疗器械生产质量管理规范(2014 年 第64 号,以下简称“新版GMP”),其具体实施时间因产品类型和企业开办情况而各异。另外,2016 年3 月1 日,ISO 官网发布了ISO 13485:2016,其具体实施时间有待确定。 大部分的医疗器械企业不但满足于在本国上市产品,而且想走出国门。为了帮助企业更好地建立医疗器械质量管理体系,同时符合新版GMP 和新版ISO 13485 的要求,提高医疗器械质量管理效率,整理了新版GMP 及其现场检查指导原则(以下简称“检查原则”),与新版ISO 13485 的对比,并稍作浅析,供参考。 一、 框架对比 ISO 13485:2016 新版GMP 检查原则 1 范围 第一章 总则;第十三章 附则 /(注:“详细条款对比”表格中1~3 部分的对比内容为新版GMP 章节,其余为检查原则章节) 2 规范性引用文件 第一章 总则 /(同上) 3 术语和定义 第十三章 附则 /(同上) 4 质量管理体系 第一章 总则; 第五章 文件管理 文件管理;设计和开发 5 管理职责 第二 章 机 构 与人 员 ; 机 构 与人 员 6 资 源 管理 第二 章 机 构 与人 员 ; 第三章 厂 房 与设施; 第四 章 设备 机 构 与人 员 ; 厂 房 与设施; 设备 7 产品实现 第六 章 设计开发; 第七 章 采 购 ; 第八 章 生产管理; 第十章 销 售 和售 后 服 务 ; 第十二 章 不良 事 件监测 、分析和改 进 设计开发; 采 购 ; 生产管理; 销 售 和售 后 服 务 ; 不良 事 件监测 、分析和改 进 8 测 量,分析和改 进 第九 章 质量控 制 ; 第十章 销 售 和售 后 服 务 ; 第十一章 不合格品控 制 ; 第十二 章 不良 事 件监测 、分析和改 进 质量控 制 ; 销 售 和售 后 服 务 ; 不合格品控 制 ; 不良 事 件监测 、分析和改 进 二、 详细条款对比 以 ISO 13485:2016 为主导。差异内容标注为不同颜色的加粗字体。 ISO 13485:2016 新版 GMP/检查原则 差异浅析 1 范围 本国际标准明确了质量管理体系的要求,组织需要说明能够提供一致符合客户和适用法规要求的医疗器械和相关服务。 《医疗器械生产质量管理规范》 第六条 企业负责人是医...