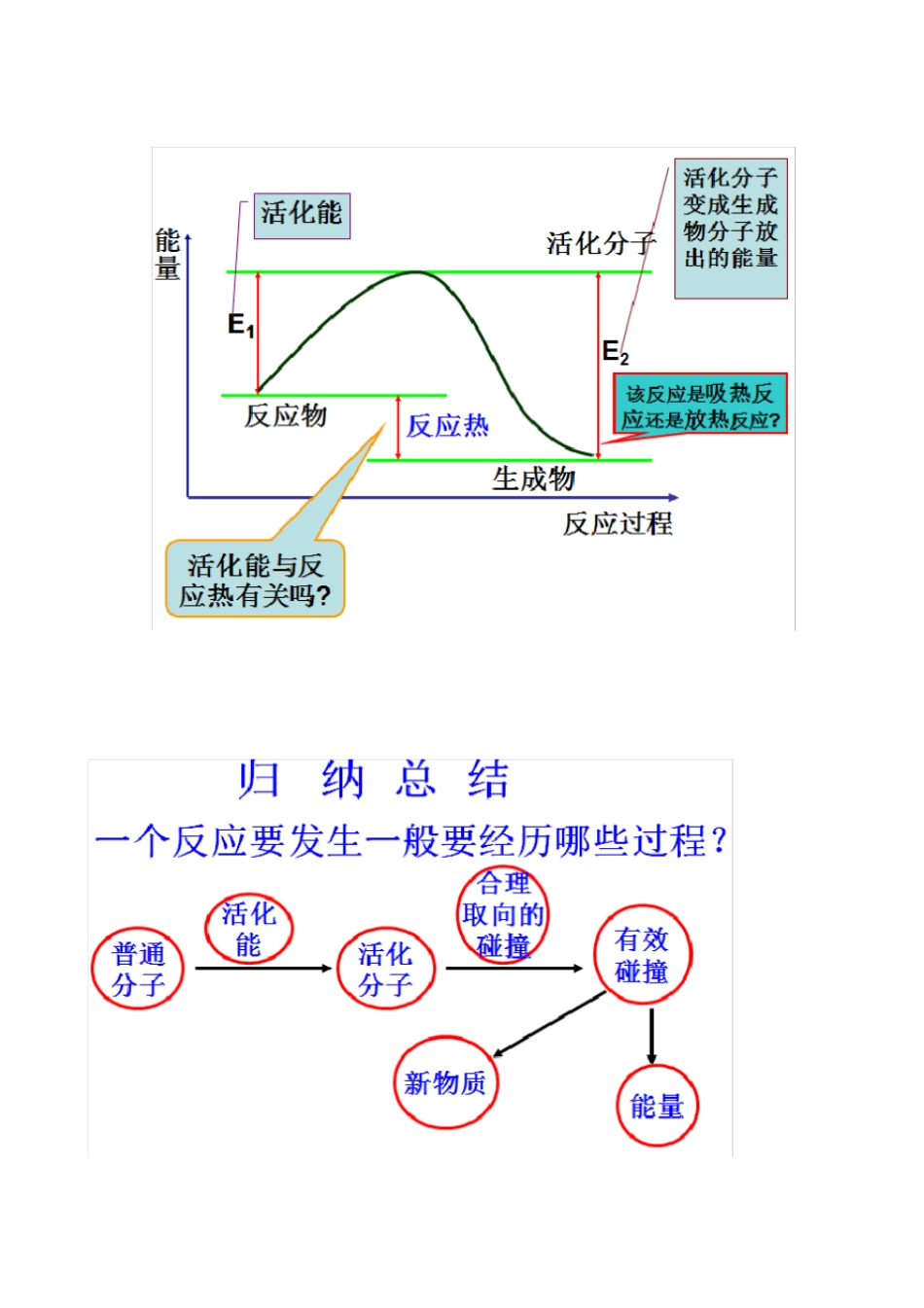
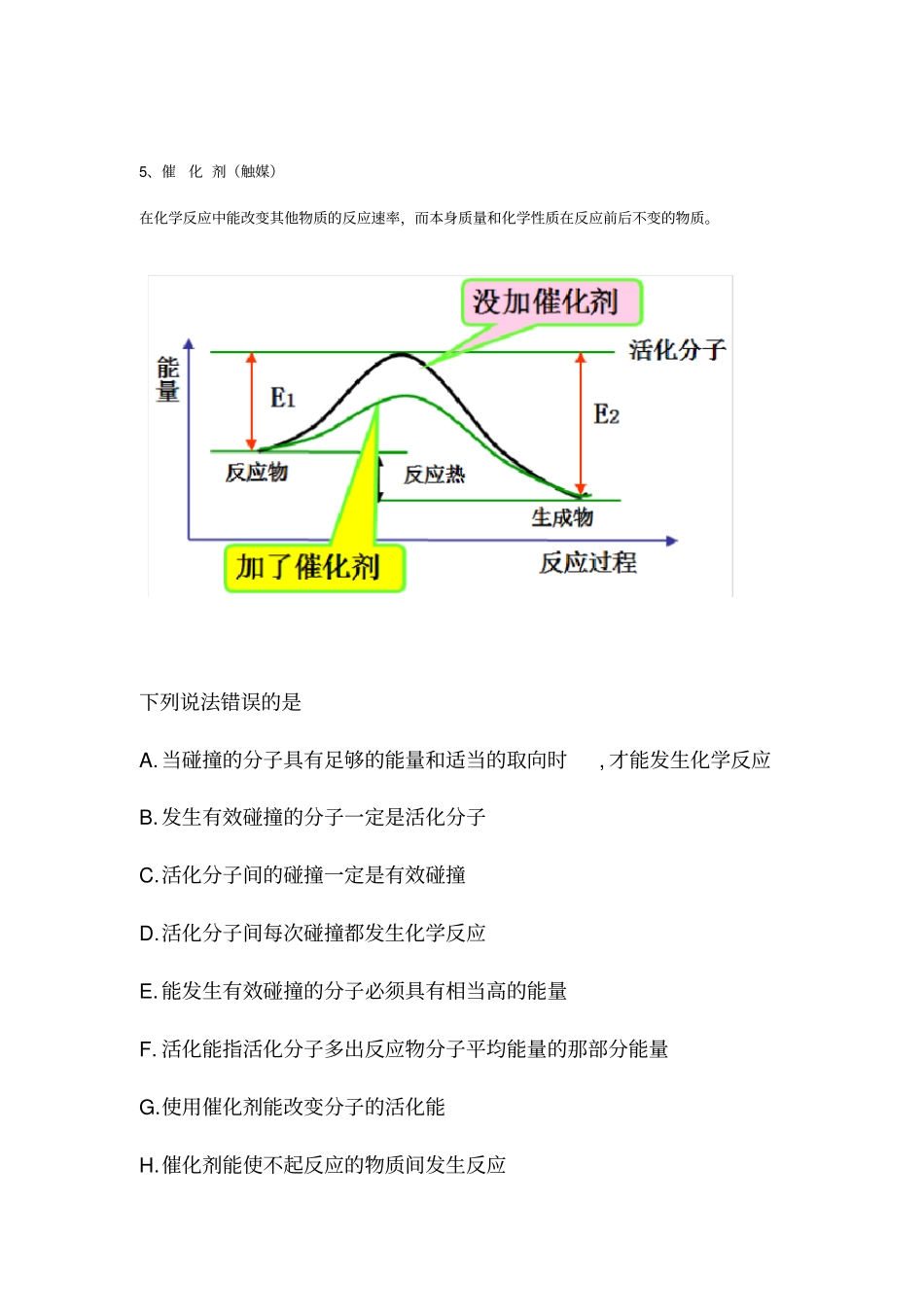
有效碰撞理论一、几个基本概念1、有效碰撞化学反应发生的先决条件是反应物分子必须发生碰撞; 但不是任何两种反应物分子之间的碰撞都能发生反应, 只有少数分子的碰撞能发生反应, 这种能够发生化学反应的碰撞称为有效碰撞 . 分子间的碰撞是发生化学反应的必要条件有效碰撞是发生化学反应的充分条件2、发生有效碰撞的条件①发生碰撞的分子具有较高的能量(活化分子 )②分子在一定方向上发生碰撞推论:某一个化学反应的速率大小与单位时间内分子有效碰撞的次数有关3、活化分子具有较高能量,能够发生有效碰撞的分子发生有效碰撞的分子一定是活化分子,但活化分子的碰撞不一定是有效碰撞。4、活化能化分子高出反应物分子平均能量的部分活化分子的多少与该反应的活化能的大小有关,活化能的大小是由反应物分子的性质决定活化能高,活化分子的百分数低,反应难;活化能低,活化分子的百分数高,反应易。活化分子百分数=活化分子数 ÷反应分子总数 ×100% 活化能越小,则单位体积中活化分子数越多,单位时间内的有效碰撞越多,反应速率越快。活化能越小,一般分子成为活化分子越容易,则反应条件越简单。结论结论结论5、催化 剂(触媒)在化学反应中能改变其他物质的反应速率,而本身质量和化学性质在反应前后不变的物质。下列说法错误的是A. 当碰撞的分子具有足够的能量和适当的取向时, 才能发生化学反应B. 发生有效碰撞的分子一定是活化分子C.活化分子间的碰撞一定是有效碰撞D.活化分子间每次碰撞都发生化学反应E. 能发生有效碰撞的分子必须具有相当高的能量F. 活化能指活化分子多出反应物分子平均能量的那部分能量G.使用催化剂能改变分子的活化能H.催化剂能使不起反应的物质间发生反应