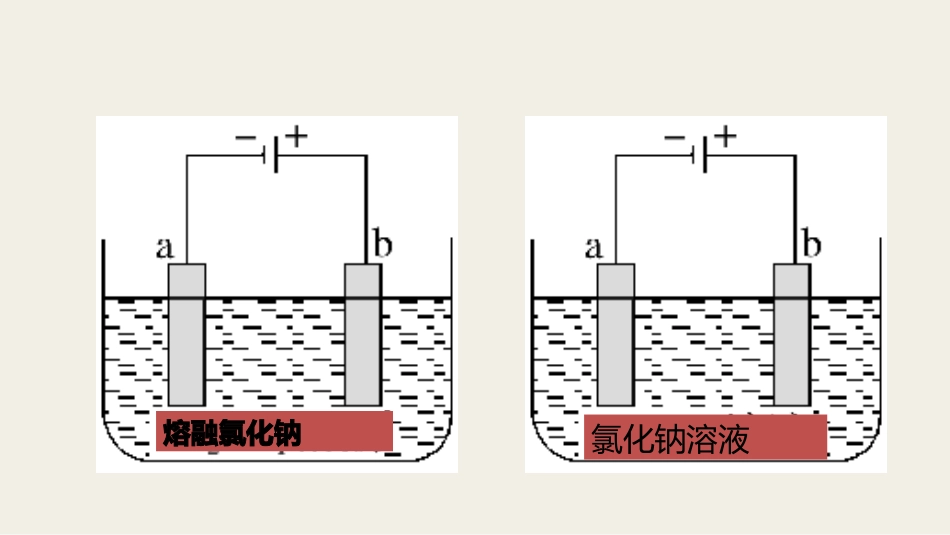
善变的原电池、始终如一的电解池高三化学组自发的,向外输送能量由外界输送的电能推动熔融氯化钠氯化钠溶液电化学解题模型:1、电解池构成条件①有与相连的两个电极。②(或)。③形成。知识梳理电源电解质溶液熔融盐闭合回路①阳极首先看电极,如果是活性电极作阳极,则电极材料失电子,电极溶解(注意:铁作阳极溶解生成Fe2+,而不是Fe3+);如果是惰性电极,则需看溶液中阴离子的失电子能力,阴离子放电顺序为S2->I->Br->Cl->OH-(水)>含氧酸根离子。阴极产物的判断直接根据阳离子的放电顺序进行判断:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。2、电解池的电极反应53、原电池的形成条件(4)形成闭合回路。(1)自发的氧化还原反应(放热反应):(2)电解质溶液或熔融的电解质参与电极反应或构成内电路(3)两导体作电极:①电极和电解质溶液②两电极上分别有还原剂和氧化剂(燃料电池)③正极和负极~~~①活动性不同的金属(或一种金属和一种非金属导体石墨),与电解质溶液反应的(一般是活泼)金属为负极。②两不活泼的导体-石墨或Pt等。(燃料电池电极)(两电极用导线连接或接触,另一端插入电解质溶液中)4.原电池电极反应式和电池反应式的书写负极:正极:银器日久表面会逐渐变黑,这是因为生成了硫化银。有人设计用原电池原理进行“抛光”,其处理方法:将一定浓度的氯化钠溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去,而银器恢复光泽,且不会损失。试回答:(1)氯化钠溶液的作用是________________________________________________。(2)在此原电池反应中,负极发生的电极反应为______________________________________,正极发生的电极反应为________________________。(3)反应过程中产生臭鸡蛋气味的气体,溶液中发生的反应为_____________________,原电池总反应方程式为___________________________________________。(1)为电解质溶液,起导电作用(2)2Al-6e-=2Al3+3Ag2S+6e-=6Ag+3S2-(3)2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑3Ag2S+2Al+6H2O=6Ag+2Al(OH)3↓+3H2S↑5、盐桥(2)盐桥的组成和作用①盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。②盐桥的作用:a、连接内电路,形成闭合回路;b、平衡电荷,使原电池不断产生电流。C、防止电极与电解质溶液接触反生自放电反应,形成稳定的电流。6、电子和离子的移动方向(2)电解池(1)原电池负极正极e-7、电极阳极:阴极:正极:负极:发生还原反应的电极叫阴极发生氧化反应的电极叫阳极电子流出的一极是负极电子流入的一极是正极-+Cl2Cl2Cl—H2Na+H+OH—淡盐水NaOH溶液精制饱和NaCl溶液H2O(含少量NaOH)离子交换膜阳极石墨阴极铁网阳极室阴极室(1)氯碱工业:离子交换膜法制烧碱8、电解的应用(1)平衡电荷,形成闭合回路;(2)防止Cl2和H2混合而引起爆炸;(3)避免Cl2与NaOH反应生成NaClO,影响NaOH的产量;(4)避免Cl-进入阴极区导致制得的NaOH不纯。阳离子交换膜作用①NaOH的产生位置:____极室。②如去掉阳离子交换膜,让阴极室与阳极室产物充分反应,总反应式为________________________________________。阴NaCl+H2O=====电解NaClO+H2↑(2)铜的电解精炼阳极:阴极:杂质比铜活泼的Zn、Ni、Fe等:Zn-2e-=Zn2+Ni-2e-=Ni2+Fe-2e-=Fe2+活泼性在铜之后的银、金等:还原性比铜差的,不能失去电子,它们以单质的形式留在溶液中,成为阳极泥。电解质溶液硫酸铜的浓度:Cu-2e-=Cu2+Cu2++2e-=Cu略有减小使用一段时间后需更换Zn>Fe>Ni金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。下列叙述中正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)()A.阳极发生还原反应,其电极反应式为Ni2++2e-===NiB.电解过程中,阳极质量的减少量与阴极质量的增加量相等C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+D.电解后,电解槽底部的阳极泥中有Cu和Pt(3)电镀1)定义:利用电解原理在某些金属的表面镀上一薄层其它金属或是合金的过程。2)目的:3)电镀材料的选择:阴极——镀件电镀液——含有镀...