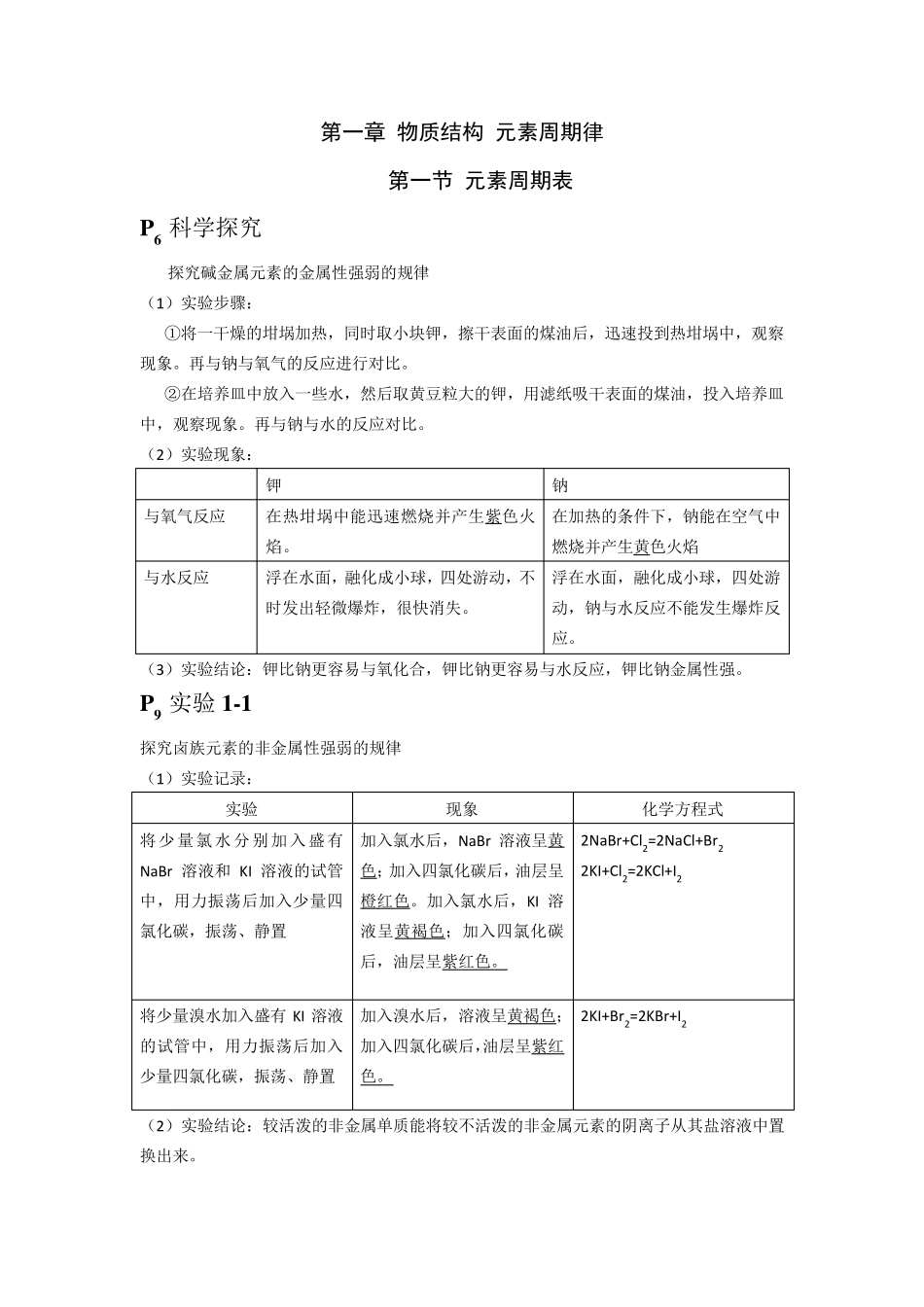
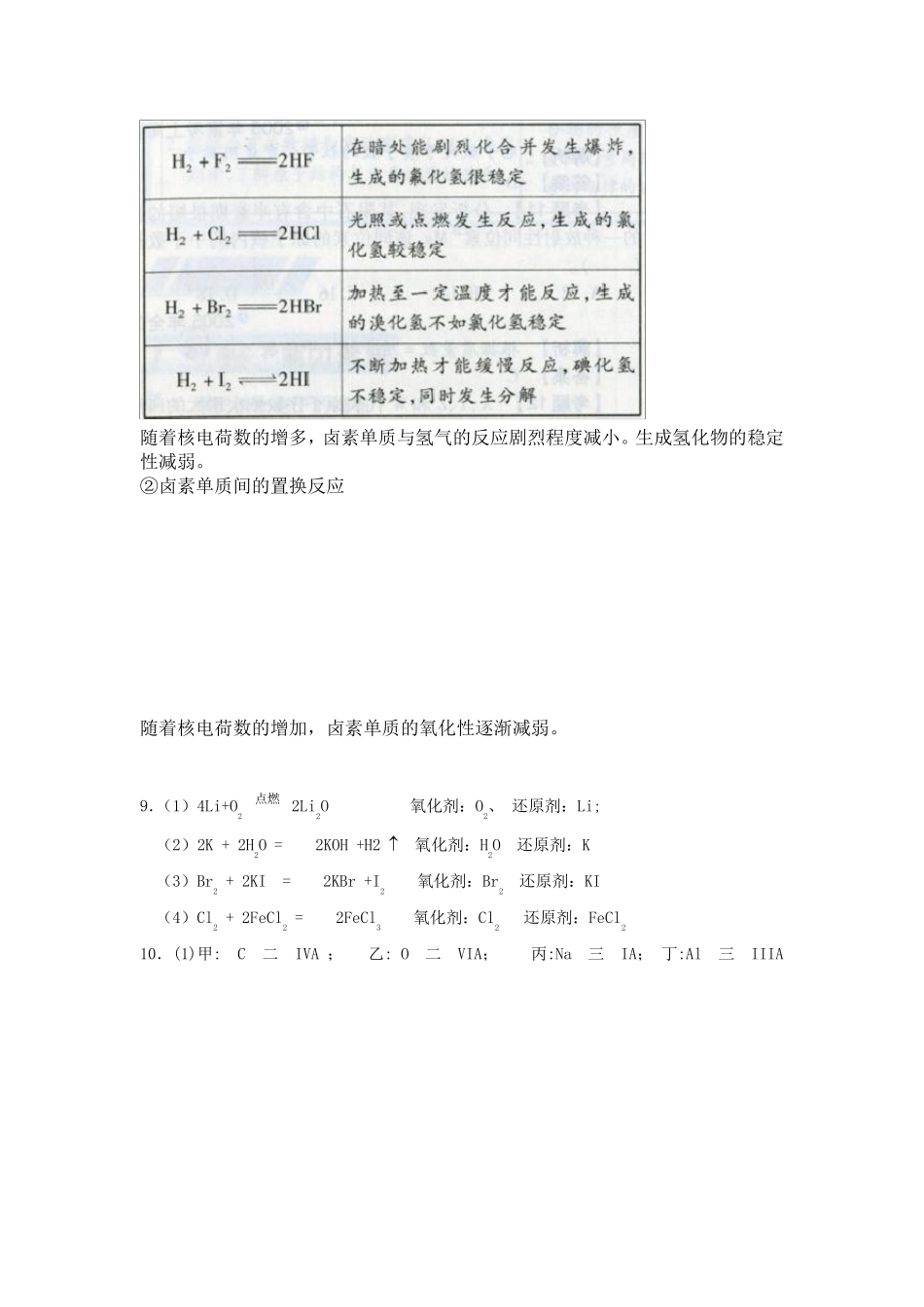
第一章 物质结构 元素周期律 第一节 元素周期表 P 6 科学探究 探究碱金属元素的金属性强弱的规律 (1)实验步骤: ①将一干燥的坩埚加热,同时取小块钾,擦干表面的煤油后,迅速投到热坩埚中,观察现象。再与钠与氧气的反应进行对比。 ②在培养皿中放入一些水,然后取黄豆粒大的钾,用滤纸吸干表面的煤油,投入培养皿中,观察现象。再与钠与水的反应对比。 (2)实验现象: 钾 钠 与氧气反应 在热坩埚中能迅速燃烧并产生紫色火焰。 在加热的条件下,钠能在空气中燃烧并产生黄色火焰 与水反应 浮在水面,融化成小球,四处游动,不时发出轻微爆炸,很快消失。 浮在水面,融化成小球,四处游动,钠与水反应不能发生爆炸反应。 (3)实验结论:钾比钠更容易与氧化合,钾比钠更容易与水反应,钾比钠金属性强。 P 9 实验1-1 探究卤族元素的非金属性强弱的规律 (1)实验记录: 实验 现象 化学方程式 将少量氯水分别加入盛有NaBr 溶液和KI 溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 加入氯水后,NaBr 溶液呈黄色;加入四氯化碳后,油层呈橙红色。加入氯水后,KI 溶液呈黄褐色;加入四氯化碳后,油层呈紫红色。 2NaBr+Cl2=2NaCl+Br 2 2KI+Cl2=2KCl+I2 将少量溴水加入盛有KI 溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 加入溴水后,溶液呈黄褐色;加入四氯化碳后,油层呈紫红色。 2KI+Br 2=2KBr+I2 (2)实验结论:较活泼的非金属单 质 能将较不活泼的非金属元素的阴 离 子 从 其 盐 溶液中置换 出来 。 由此可以判断非金属性的强弱。 P 11 习题 1.1;1;Cs;Li;7; 1;F;F。 2.C 3.C 4.A 5.(1)6 3Li 7 3Li; (2)14 6C 14 7N; (3)23 11Na 24 12Mg。 6. 7. 8.(1)卤素单质的物理性质 (2) 卤素单质的化学性质: ①卤素单质与氢气反应 随着核电荷数的增多,卤素单质与氢气的反应剧烈程度减小。生成氢化物的稳定性减弱。 ②卤素单质间的置换反应 随着核电荷数的增加,卤素单质的氧化性逐渐减弱。 9.(1)4Li+O2 点燃 2Li2O 氧化剂:O2、 还原剂:Li; (2)2K + 2H2O =2KOH +H2 氧化剂:H2O 还原剂:K (3)Br2 + 2KI =2KBr +I2 氧化剂:Br2 还原剂:KI (4)Cl2 + 2FeCl2 =2FeCl3 氧化剂:Cl2 还原剂:FeCl2 10.(1)甲: C 二 IVA ; 乙: O 二 VIA; 丙:Na 三 IA; 丁:Al 三 IIIA (2)甲...