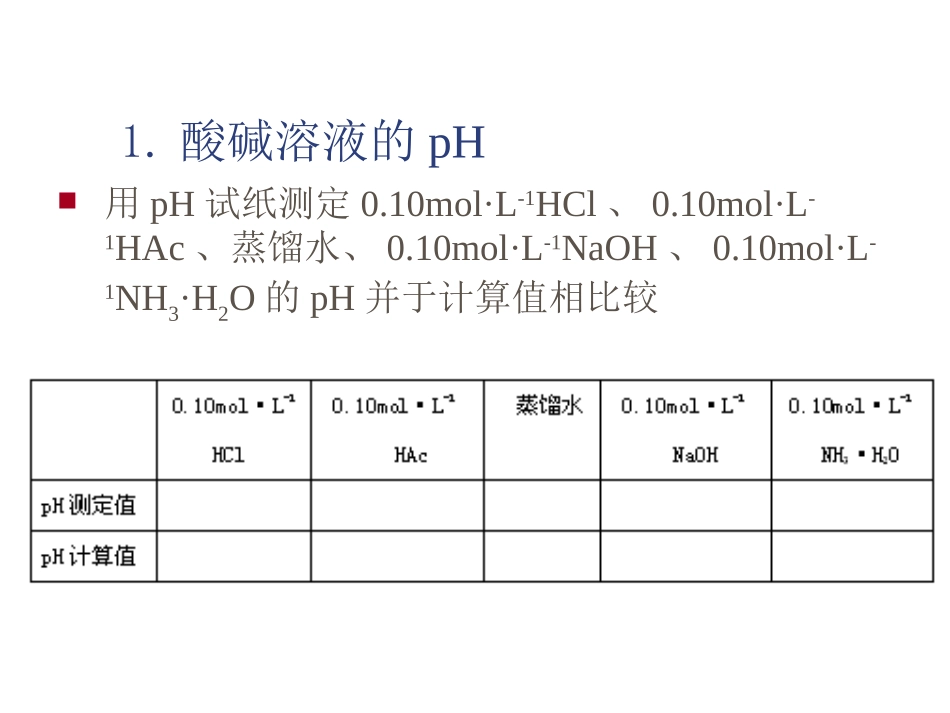
实验六.电离平衡和沉淀平衡一.实验目的:1.了解同离子效应对电离平衡的影响;2.了解盐的水解及影响因素;3.了解沉淀的生成及溶解的条件。实验内容1.酸碱溶液的pH值2.同离子效应3.盐类水解及影响因素.4.沉淀平衡与同离子效应5.溶度积规则的应用6.氢氧化镁溶度积的预测1.酸碱溶液的pH用pH试纸测定0.10mol·L-1HCl、0.10mol·L-1HAc、蒸馏水、0.10mol·L-1NaOH、0.10mol·L-1NH3·H2O的pH并于计算值相比较2.同离子效应(1)在试管中加入5滴0.10mol·L-1HAc溶液和1滴溴甲酚绿-甲基橙混合指示剂,摇匀观察溶液颜色。再加入固体NH4Ac少许,振摇使之溶解,观察溶液盐的变化,解释之。(2)在试管中加入5滴0.10mol·L-1NH3·H2O和1滴酚酞指示剂,摇匀,观察溶液颜色。再加入固体NH4Ac少许,振摇使之溶解,溶液颜色有何变化,解释原因。3.盐类的水解及其影响因素(1)盐溶液的pH(2)温度对水解平衡的影响在试管中加入0.5mol·L-1NaAc溶液1ml和1滴酚酞指示剂,加热后观察溶液颜色的变化,并解释。(3)溶液酸度对水解平衡的影响在试管中加米粒大Bi(NO3)3固体,再加少量水,摇匀后观察现象。然后往试管中加6mol·L-1HCL溶液至沉淀完全溶解为止。在用水稀释又有何变化?解释有关现象在配制Bi(NO3)3溶液是应该主义什么问题?还能找出类似的盐类吗?(4)在试管中加入Al2(SO4)3溶液1ml,然后加入0.5mol·L-1NaHCO3溶液1ml,有何现象?用水解平衡观点解释,写出反应方程式并说明该反应的实际应用。4.沉淀平衡与同离子效应(1)沉淀平衡取0.1mol·L-1Pb(NO3)2溶液10滴,加0.5mol·L-1NH4(SCN)溶液至沉淀完全,振荡试管.离心分离,在离心液中加0.1mol·L-1K2CrO4溶液,振荡试管,有什么现象?说明在沉淀移去后离心液中还有Pb2+。(2)同离子效应在试管中加1ml饱和PbI2溶液,然后加5滴0.1mol·L-1KI溶液,振荡片刻,观察有何现象产生?为什么?5.溶度积规则应用(1)沉淀的生成1)在试管中加0.1mol·L-1Pb(NO3)2溶液1ml,然后加0.1mol·L-1KI溶液1ml,观察有无沉淀生成。试以溶度积规则解释之。2)在试管中加0.1mol·L-1Pb(NO3)2溶液1ml,然后加0.001mol·L-1KI溶液1ml,观察有无沉淀生产。试以溶度积规则解释之。3)在离心管中加0.1mol·L-1Na2S溶液5滴和0.1mol·L-1K2CrO4溶液5滴,加蒸馏水5ml稀释,再加0.1mol·L-1Pb(NO3)2溶液5滴,观察首先生成的沉淀是黑色还是黄色?离心分离,再先离心液中滴加0.1mol·L-1Pb(NO3)2溶液会出现什么颜色的沉淀?根据有关溶积规则加以说明。(2)沉淀的溶解1)取0.1mol·L-1BaCl2溶液5滴,加饱和草酸铵溶液3滴,此时有白色沉淀生成,离心分离,弃去溶液,在沉淀上滴加6mol·L-1HCl溶液,有何现象?CaC2O4+2HCl==H2C2O4+CaCl22)取0.1mol·L-1AgNO3溶液10滴,加0.1mol·L-1NaCl溶液10滴,离心分离,弃去溶液,在沉淀上滴加2mol·L-1氨水溶液,有何现象?AgCl+2NH3==[Ag(NH3)2]++2Cl-3)取0.1mol·L-1FeCl3溶液5滴,加0.2mol·L-1NaOH溶液5滴,生成Fe(OH)3沉淀;另取0.1mol·L-1CaCl2溶液5滴,加0.1mol·L-1Na2CO3溶液5滴,得CaCO3分别在沉淀上滴加6mol·L-1HCl,观察现象,写出反应式。4)在试管中加0.2mol·L-1MgCl2溶液10滴,再滴加2mol·L-1的氨水,观察有何现象,然后再滴加1mol·L-1NH4Cl溶液,又有何现象发生?5)在有0.1mol·L-1CuSO4溶液5滴的试管中加0.1mol·L-1Na2S溶液5滴,观察有何现象?然后向试管中滴加6mol·L-1HNO3溶液10滴,并微热之,观察现象,写出反应式。3CuS+8HNO3==3Cu(NO3)2+3S+2NO+4H2O(3)沉淀的转化1)取0.1mol·L-1Pb(NO3)2溶液5滴,加0.5mol·L-1NaCl溶液3滴,有白色沉淀生成,在加5滴硫代乙酰胺溶液,水浴加热,有何现象?CH3CSNH2+2H2OCH3COONH4+H2SPbCl2+H2S==PbS+2HCl2)在有0.1mol·L-1AgNO3溶液10滴的试管中,加0.1mol·L-1K2CrO4溶液10滴,然后滴加0.1mol·L-1NaCl溶液,观察现象。Ag2CrO4+2HCl=2AgCl+H2CrO46.氢氧化镁溶度积的预测取50ml烧杯1只,加0.2mol·L-1MgCl2溶液25ml,烧杯底部衬一黑纸。在MgCl2溶液中逐滴滴入0.2mol·L-1NaOH溶液,并不断搅拌,直到开始有沉淀产生,NaOH溶液不能过量,为什么?放置,用pH试纸测其溶液的pH值,计算[OH]-和Ksp。