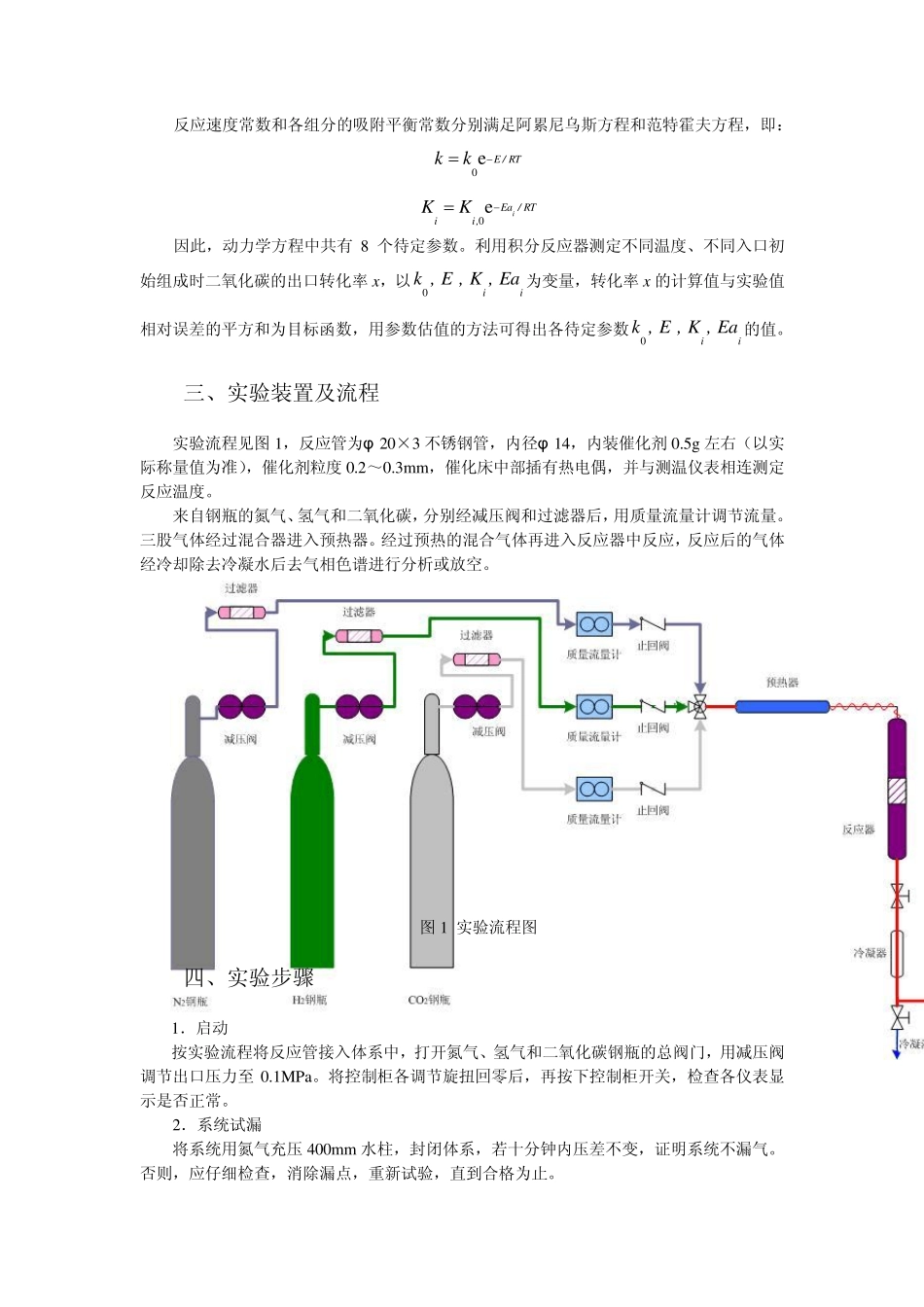
化学反应工程实验 河北科技大学 化学与制药工程学院 化学反应工程课程组 实验1 二氧化碳甲烷化反应动力学的测定 一、实验目的 测定催化剂的反应动力学数据及确定动力学方程中各参数值是化学动力学研究的重要内容,也是工业反应器设计的基础。本实验通过测定不同温度下、不同初始组成的二氧化碳甲烷化反应的转化率,掌握一种获得气固相催化反应速度常数以及吸附平衡常数的定方法。 二、实验原理 二氧化碳与水蒸汽在镍催化剂存在下,进行如下甲烷化反应: 02242298CO +4H =CH +2H O 165 08kJ/molH. 催化剂以氧化镍为主要成分,三氧化二铝为载体,氧化镁或三氧化二铬为促进剂,在使用前,需将氧化镍还原成具有催化活性的金属镍。 反应的动力学方程为: 22222222221 3COCOHCO2COCOHHH OH Od mol CO /(s g cat.)d1/NkpprWKpKpKp 220CO0COddd22 4dNV yxW.W 2222222221 3COH00COCOCOHHH OH Od22 4d1/kppx.WV yKpKpKp 分离变量并积分得: 2222222220COCOHHH OH O0CO1 30COH1d22 4x/KpKpKpV yWx. kpp 因为二氧化碳甲烷化反应为变体积的反应,各组分分压可表示为(假设混合气体在低压下符合道尔顿分压定律): 222222222222222200COCOCOCOCO00H OH OCOCOCO000HHHCOCOCO(1) (1)2(1)(4) (1)ppypyxyxppypyxyxppyp yyxyx 以上各式中, k 为反应速度常数;222( =CO , H O, H )iK i为各组分的吸附平衡常数;222COH OHy,y,y为反应物瞬时摩尔分率;222000COH OHy,y,y为初始反应物摩尔分率;0V 为进口混合气体流量,Nm3/h;W 为催化剂质量,g;2CO为该反应的化学膨胀因子,这里为-2。 反应速度常数和各组分的吸附平衡常数分别满足阿累尼乌斯方程和范特霍夫方程,即: 0e E / RTkk 0eiEa / RTii,KK 因此,动力学方程中共有8 个待定参数。利用积分反应器测定不同温度、不同入口初始组成时二氧化碳的出口转化率x ,以0 k , E ii, K , Ea 为变量,转化率x 的计算值与实验值相对误差的平方和为目标函数,用参数估值的方法可得出各待定参数0 k , E ii, K , Ea 的值。 三、实验装置及流程 实验流程见图1,反应管为φ 20×3 不锈钢管,内径φ 14,内装催化剂 0.5g 左右(以实际称量值为准),催化剂粒度0.2~0.3m m ,催化床中部插有热电偶,并...