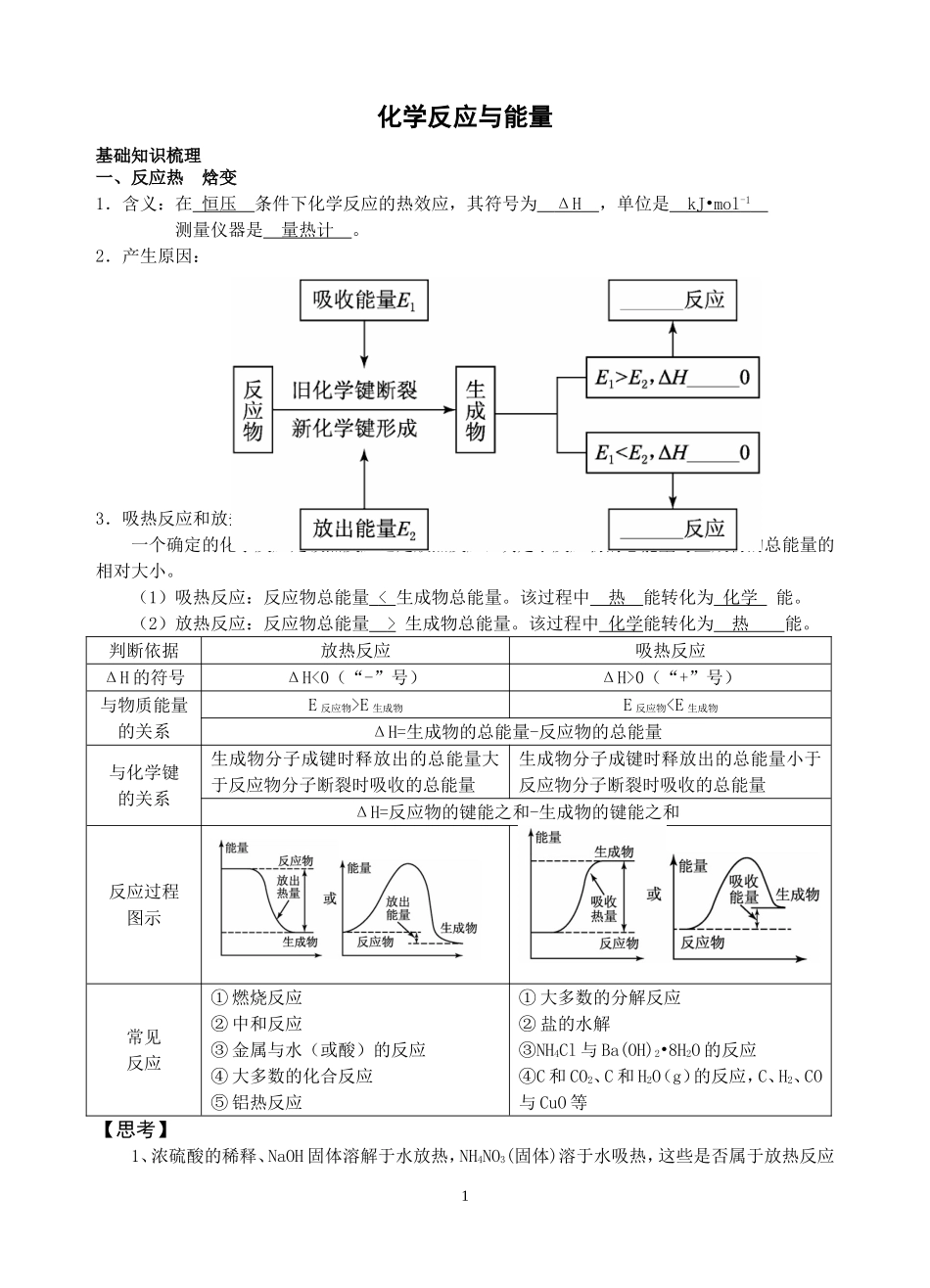
1化学反应与能量基础知识梳理一、反应热焓变1.含义:在恒压条件下化学反应的热效应,其符号为ΔH,单位是kJ•mol-1测量仪器是量热计。2.产生原因:3.吸热反应和放热反应一个确定的化学反应是吸热反应还是放热反应,决定于反应物的总能量与生成物的总能量的相对大小。(1)吸热反应:反应物总能量<生成物总能量。该过程中热能转化为化学能。(2)放热反应:反应物总能量>生成物总能量。该过程中化学能转化为热能。判断依据放热反应吸热反应ΔH的符号ΔH<0(“-”号)ΔH>0(“+”号)与物质能量的关系E反应物>E生成物E反应物A(l)>A(s)(3)注明反应的温度和压强。若不注明,即指该反应的∆H在常温常压下测定(4)热化学方程式中的化学计量系数只表示物质的量,不表示分子数因此化学计量系数既可以是整数,也可以是分数。且∆H的大小与方程式中的化学计量系数成正比,如果化学计量系数加倍时,则∆H也要加倍。当反应逆向进行时,逆反应的∆H与正反应的∆H绝对值相等,符号相反。如2H2(g)+O2(g)=2H2O(l)∆H1H2(g)+1/2O2(g)=H2O(l)∆H22H2O(l)=2H2(g)+O2(g)∆H3(5)一般不需注明反应条件(如加热、点燃等)。(6)中间用“=”不用“→”,常见的可逆反应仍用“”,但要注意理解其含义。【要点深化】1、判断热化学方程式正误的“四看”法(1)“一看”各物质的聚集状态是否正确;(2)“二看”∆H的“+”、“-”是否正确;(3)“三看”反应热的单位是否为kJ/mol则∆H1、∆H2、∆H3三者之间的关系为:H∆1=2H∆2=-H∆33(4)“四看”反应热数值与化学计量数是否对应。2、根据两个热化学方程式比较反应热大小时要注意:(1)物质的聚集状态及其化学计量数;(2)反应热所带的“+”、“-”号均具有化学意义,参与大小比较。三燃烧热和中和热1.燃烧热(1)概念:在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。燃烧热的单位一般...