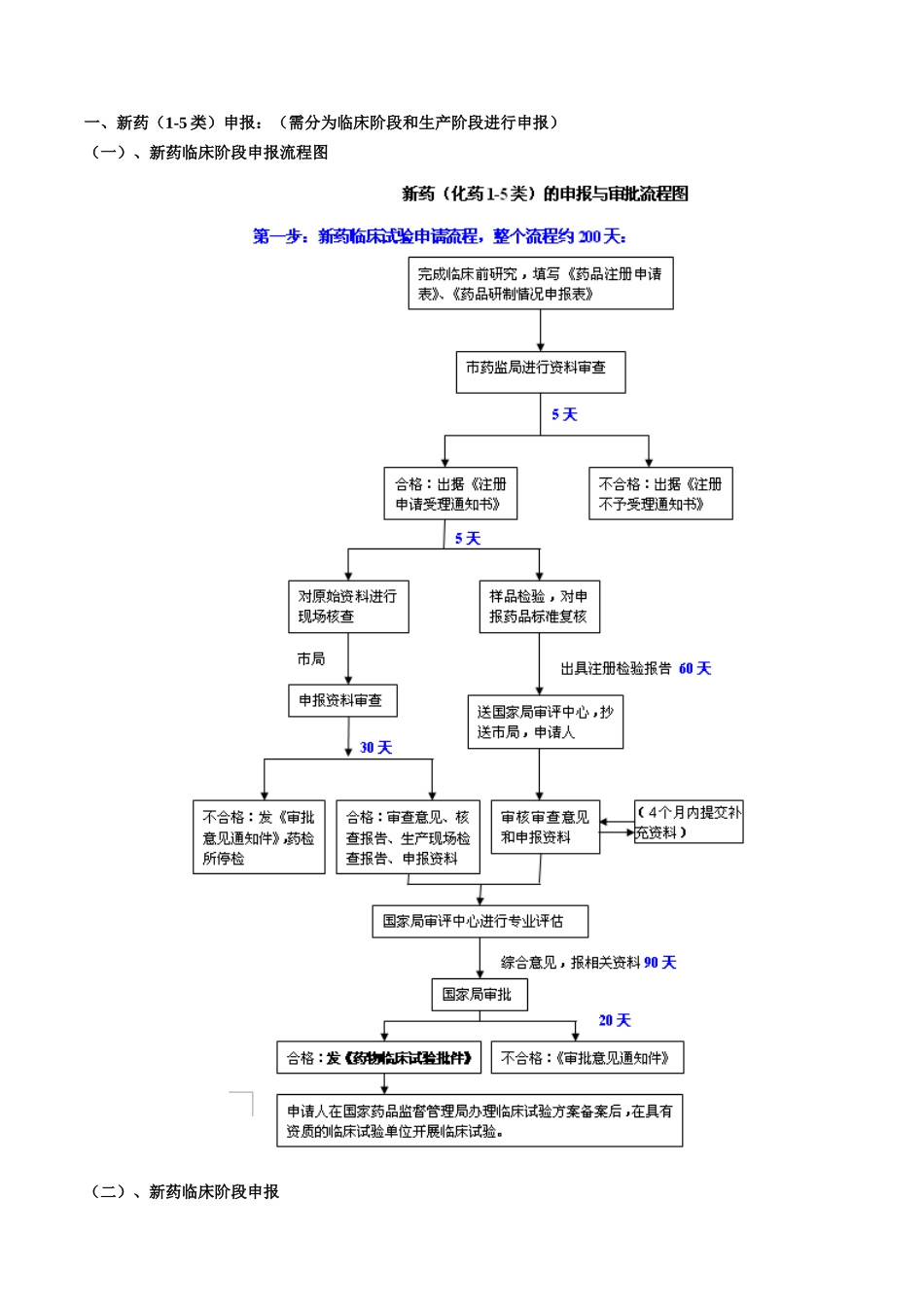
化学药品申报注册流程目录化学药品申报注册流程.....................................................................................................................................-1-目录.....................................................................................................................................................-1-(一)、新药临床阶段申报流程图.................................................................................................-2-(二)、新药临床阶段申报.............................................................................................................-2-(三)、新药生产阶段申报流程图.................................................................................................-5-(四)新药生产阶段申报.................................................................................................................-6-二、仿制药(6类):(仅需在生产阶段进行申报)...........................................................................-9-(一)、仿制药申报流程图:.........................................................................................................-9-(二)、仿制药申报流程...............................................................................................................-10-三、其他...................................................................................................................................................-13-(一)1~6类药品临床试验资料备案:.......................................................................................-13-(二)1~6类注册审评中的补充资料提交要求:......................................................................-13-(三)申报资料项目表及说明.......................................................................................................-15-(四)注意事项:...........................................................................................................................-17-2010年9月一、新药(1-5类)申报:(需分为临床阶段和生产阶段进行申报)(一)、新药临床阶段申报流程图(二)、新药临床阶段申报(1)、资料准备:1号资料(药品名称):表述药品名称,阐明名称命名理由或来源,新剂型、新命名、应附上药典委员会命名的复函。2号资料(证明性文件):1、申报人的资质:生产厂的“三证”(即:法人营业执照、税务登记证、组织机构代码证。注意名称地址的一致和有效期);除生产企业外的合作研究方同时申请新药证书需提供有效的营业执照、研究单位的法人证书及其变更登记证明2、专利查询报告、不侵权保证书(加盖所有申请人的红章)3、属特殊药品的须有SFDA安监司的立项批件(国家食品药品监督管理局对下列申请可以实行特殊审批:(一)未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂,新发现的药材及其制剂;(二)未在国内外获准上市的化学原料药及其制剂、生物制品;(三)治疗艾滋病、恶性肿瘤、罕见病等疾病且具有明显临床治疗优势的新药;(四)治疗尚无有效治疗手段的疾病的新药。)4、制剂用原料药的合法来源(上省批件或进口注册证、原料厂家的三证、供货协议、购买发票、质量标准、出厂报告书及自检报告书),向经销单位购买的,还需提供经销商与原料厂的供货协议5、申请人同时申报原料与制剂的则不提供“4”的资料,若同时申请原料和制剂的厂家不是同一家,则须提供原料厂与制剂厂之间的供货协议或合作开发协议以及原料药受理单。(相同制剂,原料药只能和一个申请人合作申报)。6、拟申请商品名的提供商标查询单或商标注册证(例:波利维—硫酸氯吡格雷;拜糖平—阿卡波糖;格华止—盐酸二甲双胍)7、直接接触药品的包装材料...