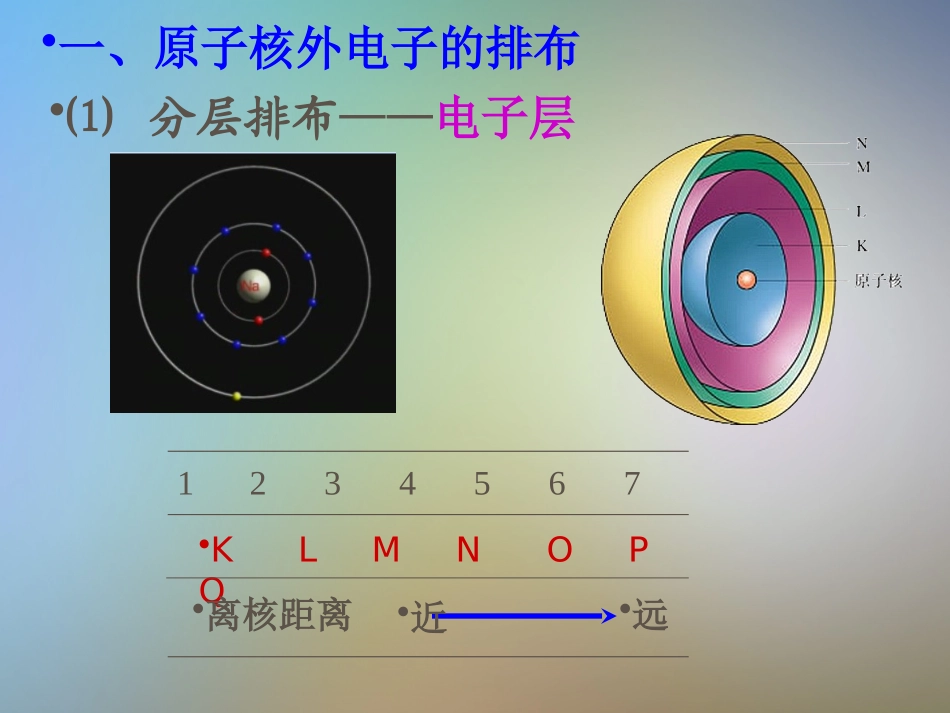
原子核外电子的排布•第一章•物质结构元素周期律•第二节•第一课时•元素周期律•原子核外电子的排布学习目标:1.掌握原子核外电子排布的规律2.能画出原子或离子的结构示意图•⑴分层排布——电子层•一、原子核外电子的排布1234567•KLMNOPQ•离核距离•近•远•在离核较近的区域内运动的电子能量较低,•离核较远的区域内运动的电子能量较高。•⑵能量内低外高•原子核外的电子总是尽可能地先从内层排起,一层排满后再排下一层。•+1•1•H•+2•2•He•+3•1•2•Li•+4•2•2•Be•+5•3•2•B•+6•4•2•C•+7•5•2•N•+8•6•2•O•+9•7•2•F•+10•8•2•Ne•3•+11•2•8•1•Na•2•+12•2•8•Mg•+13•2•8•Al•4•+14•2•8•Si•+15•2•8•5•P•8•6•+16•2•S•7•+17•2•8•Cl•+18•2•8•8•Ar•+19•2•8•8•1•+20•2•8•8•2•+31•2•8•18•3•+32•2•8•18•4•+33•2•8•18•5•+34•2•8•18•6•+35•2•8•18•7•+36•2•8•18•8•Ca•Ga•Ge•As•Se•Br•Kr•K•前四周期元素原子的结构示意图核电荷数元素名称元素符号各电子层的电子数KLMNOP2氦He210氖Ne2818氩Ar28836氪Kr2818854氙Xe281818886氡Rn281832188•118•28183232188•二、原子核外电子排布规律•1、电子总是先从能量低的K层排起•2、每一个电子层可容纳2n2个电子•(n表示电子层数);•3、最外层可容纳的电子数不能超过8个•(K层是最外层时,最多不超过2个),•4、次外层不能超过18个,倒数第三层•不能超过32个。•三.离子的结构示意图•+11•2•8•1•Na•失去e-•Na+•+11•2•8•形成与上一周期0族元素的原子•相同的电子层结构•O•得到2e-•O2-•+8•2•8•形成与同一周期0族元素的原子•相同的电子层结构•+8•6•2•+10•8•2•Ne•练习•1.画出37Rb、34Se和53I的原子结构示意图•2.含有10个电子的原子或离子有哪些?•(有O2-,F-,Ne,Na+,Mg2+等)•电子排布:2,8,18,8,1•2,8,18,6•2,8,18,18,7•核外有10个电子的粒子:•分子:•阳离子:•阴离子:•CH4;NH3;H2O;HF;Ne•NH4+;H3O+;Na+;Mg2+;Al3+•N3-;NH2-;O2-;OH-;F-•分子:ArHClH2SPH3SiH4H2O2F2•离子•K+Ca2+•Cl-S2-HS-O22-•核外有18个电子的粒子有哪些?•3.已知元素Xm+、Yn-的核电荷数分别为a、b,它们的离子核外电子排布相同,则a=。•6.1-10号元素组成的物质中,•①由2个原子核10个电子结合成的分子是。•②由5个原子核10个电子结合成的分子是。•b+m+n•4.已知元素Xm-、Yn+、Zp+具有相同的电子层结构,已知:n>p,则它们核内质子数的关系为。•Y>Z>X•5.短周期元素中,某元素原子核外L层电子数是其它层电子数之和的2倍,则该元素为。•CMg•HF•CH4•7.X、Y、Z三种元素,其核电荷数均小于20,•(1)X原子最外层电子数是次外层电子数的2倍,•(2)Y原子的次外层电子数是最外层电子数的2倍,•(3)Z原子的次外层电子数是最外层电子数的4倍,•则三种元素分别是:•X电子排布是2,4,是碳元素•Y电子排布是2,8,4是硅元素或•2,1是锂元素•Z电子排布是2,8,2是镁元素•注意:熟记短周期元素原子的核外电子排布。