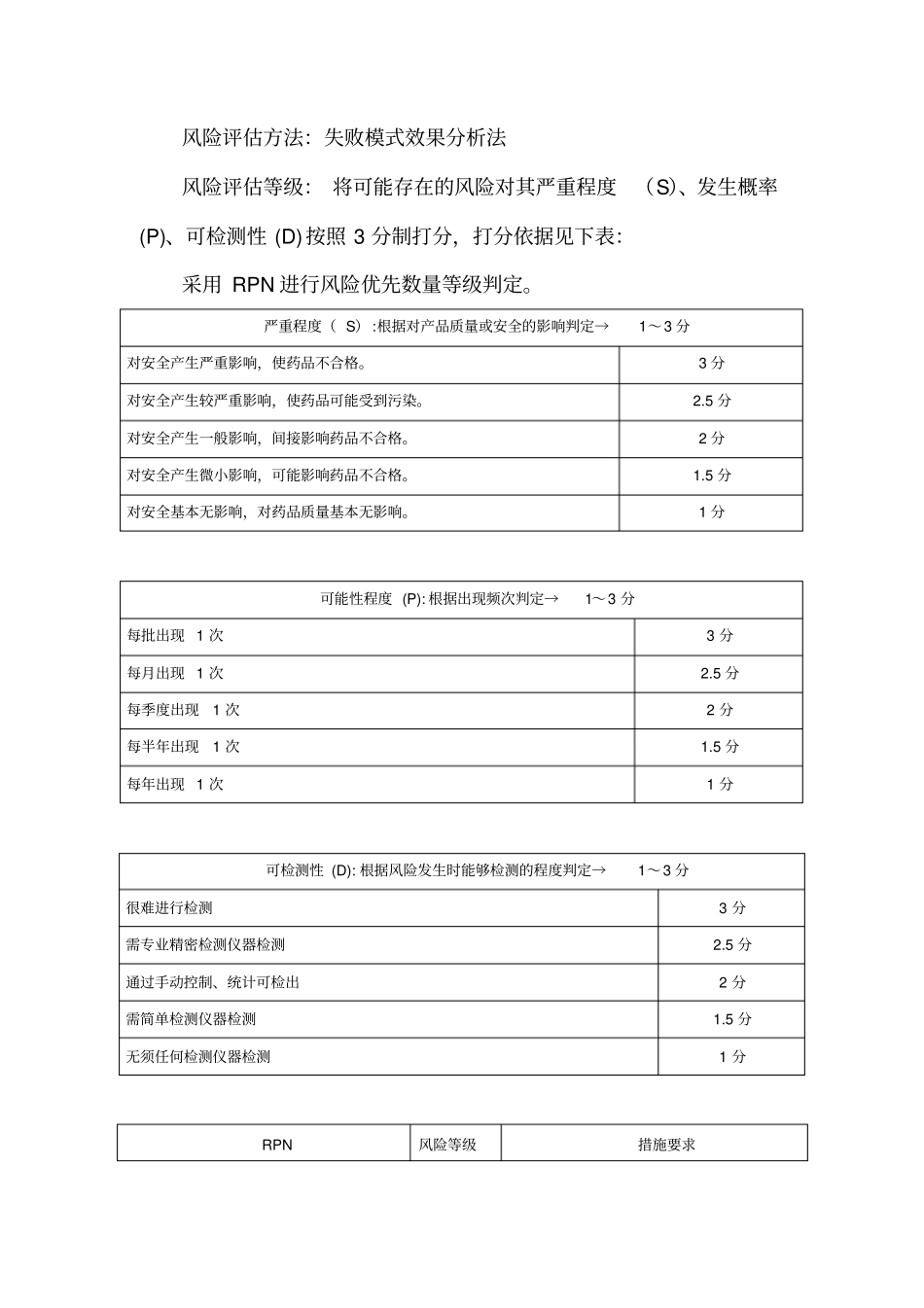
XXXX药业有限公司关于药品不良反应检查的整改报告XXXX食品药品稽查局:2018 年 11 月 15 日由 XXX、XXX、XXX组成的检查小组, 依据《药品不良反应报告和监测管理办法》( 卫生部令第 81 号) 及《药品不良反应报告和监测检查指南(试行) 》对我公司的药品不良反应报告和监测、组织机构、人员管理、工作程序、培训记录,相关监测工作开展情况进行现场检查, 并对出现的问题进行了分析指导,检查中共提出一般缺陷项 2 项。针对检查组提出的不合格项目,我公司领导高度重视, 认真分析原因,确定整改责任人和整改期限,积极整改。具体整改情况如下:一、企业对相关部门的不良反应培训监测培训未覆盖到销售代理商。1、不合格项描述: 我公司生产的中药制剂包括XXX 颗粒、XXX颗粒、XXXXXXX糖浆、XXXXXX糖浆,由于市场因素,这5 个制剂品种没有达到满负荷的生产,并且每年不是同时开展生产, 因此目前生产量较少的现状下, 对不良反应培训监测培训涉及了不良反应办公室、生产及销售部门。2、原因分析:对《药品不良反应报告和监测管理办法》等文件理解不透彻、不全面,在日常培训工作中只是对不良反应办公室、生产和销售部门进行了培训,未覆盖到销售代理商。3、风险分析,选择风险评估工具:风险评估方法:失败模式效果分析法风险评估等级: 将可能存在的风险对其严重程度(S)、发生概率(P)、可检测性 (D)按照 3 分制打分,打分依据见下表:采用 RPN 进行风险优先数量等级判定。严重程度( S) :根据对产品质量或安全的影响判定→1~3 分对安全产生严重影响,使药品不合格。3 分对安全产生较严重影响,使药品可能受到污染。2.5 分对安全产生一般影响,间接影响药品不合格。2 分对安全产生微小影响,可能影响药品不合格。1.5 分对安全基本无影响,对药品质量基本无影响。1 分可能性程度 (P): 根据出现频次判定→1~3 分每批出现 1 次3 分每月出现 1 次2.5 分每季度出现1 次2 分每半年出现1 次1.5 分每年出现 1 次1 分可检测性 (D): 根据风险发生时能够检测的程度判定→1~3 分很难进行检测3 分需专业精密检测仪器检测2.5 分通过手动控制、统计可检出2 分需简单检测仪器检测1.5 分无须任何检测仪器检测1 分RPN 风险等级措施要求严重程度 (S)×可能性程度 (P)×可检测性 (D) <4 低此风险水平可接受,无需采取额外措施。9≥ RPN≥4 中须采取控制措施。 通过提供可检测性及降低可能性来...