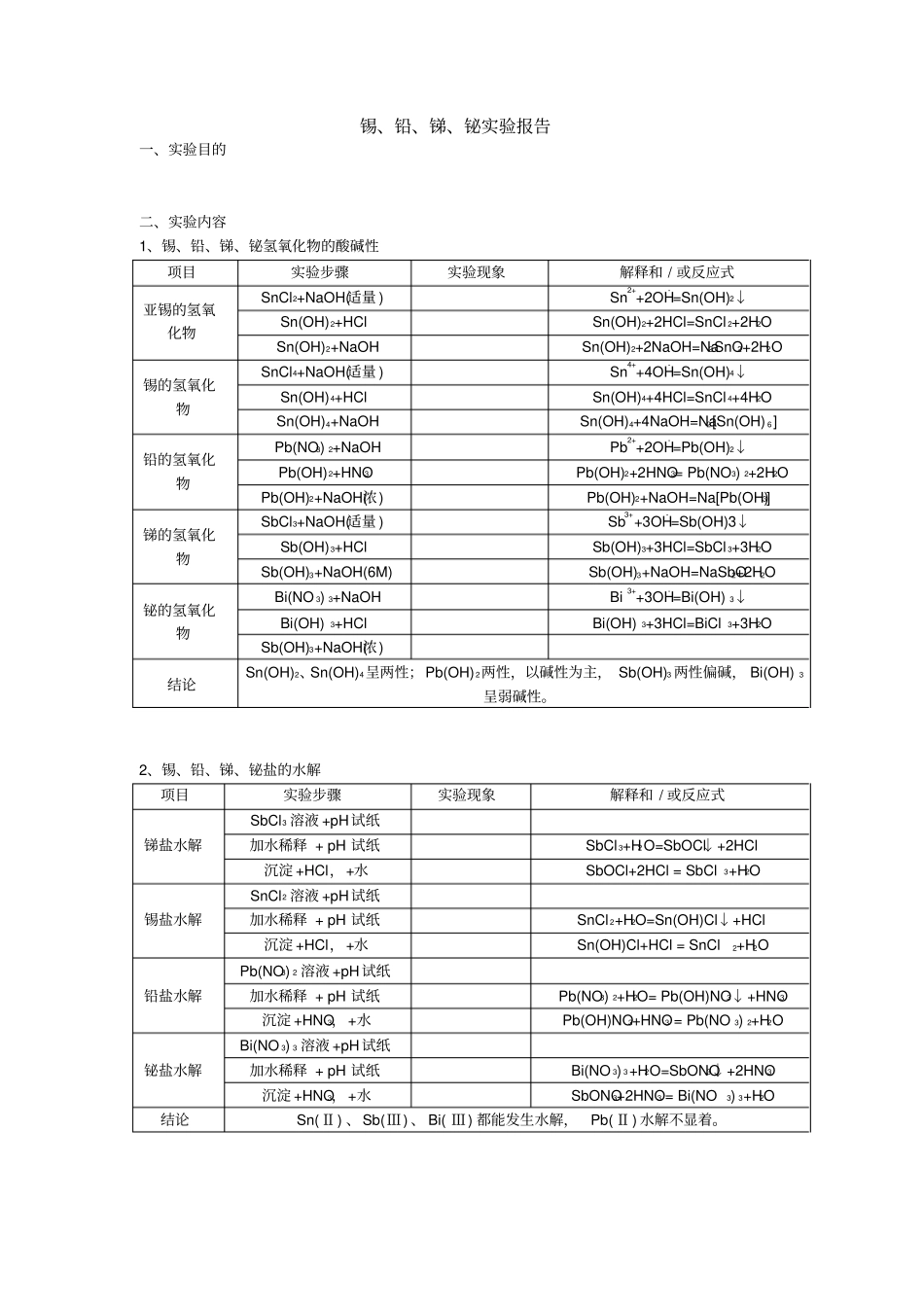
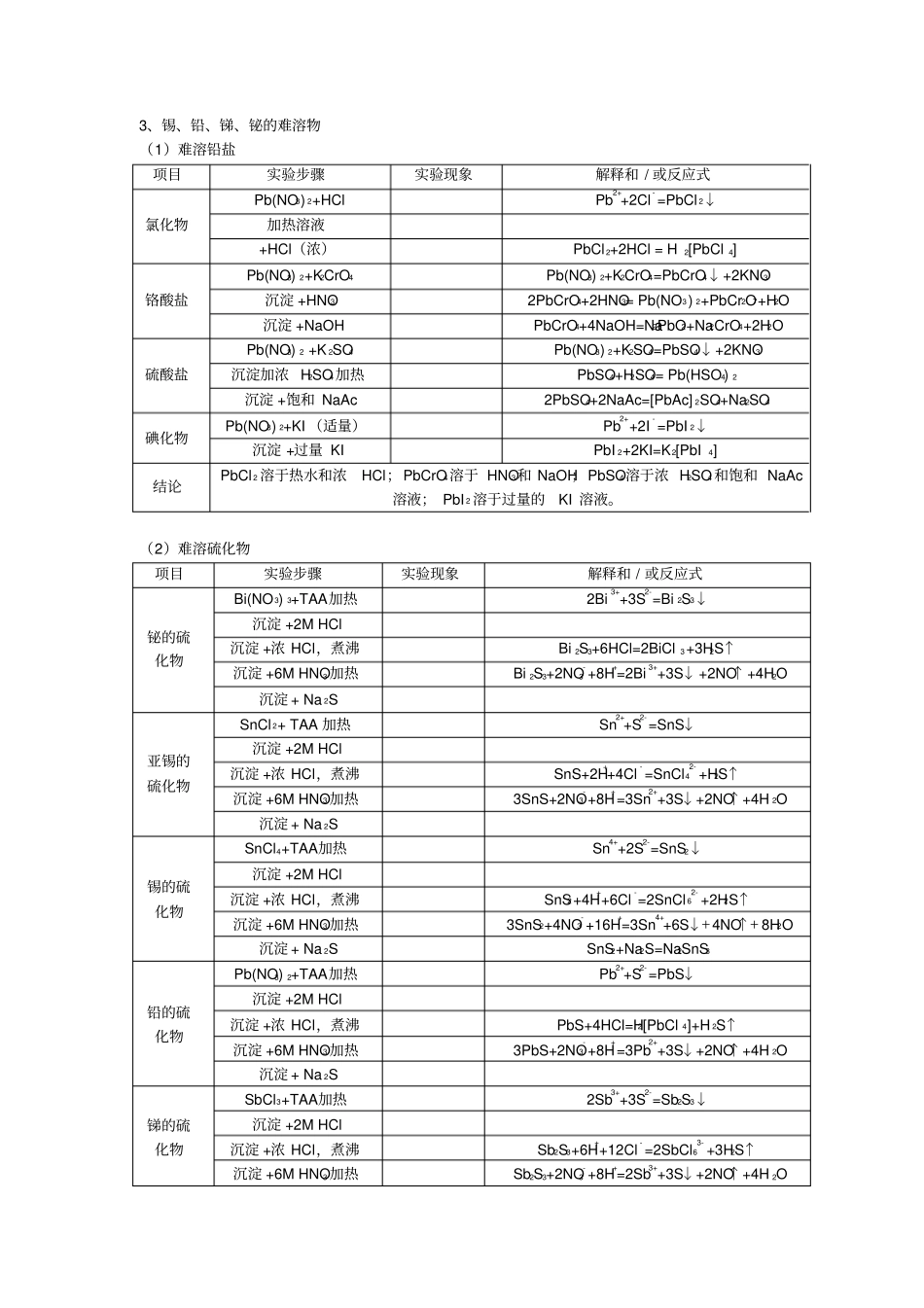
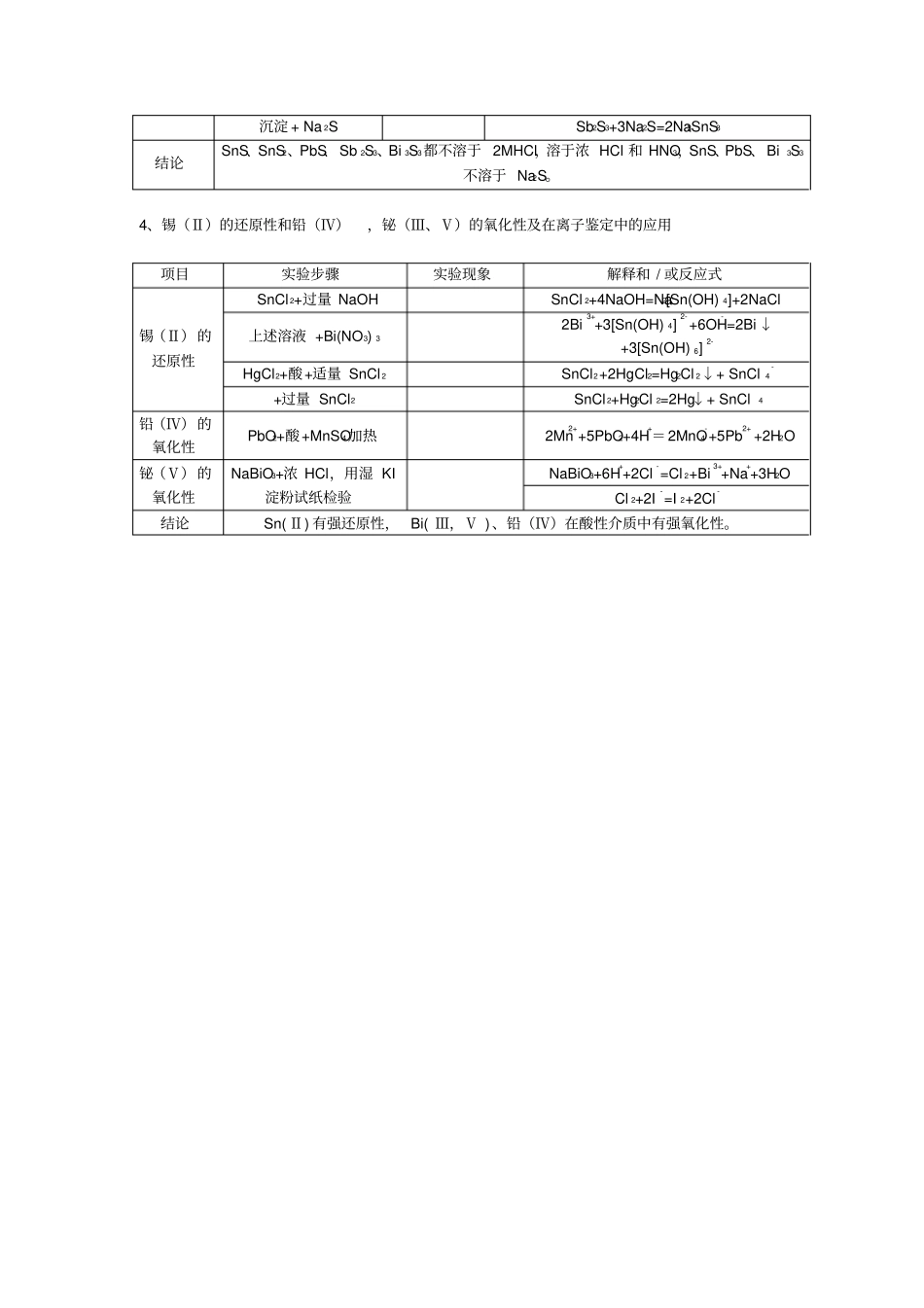
锡、铅、锑、铋实验报告一、实验目的二、实验内容1、锡、铅、锑、铋氢氧化物的酸碱性项目实验步骤实验现象解释和 / 或反应式亚锡的氢氧化物SnCl2+NaOH(适量 )Sn2++2OH- =Sn(OH)2↓Sn(OH)2+HClSn(OH)2+2HCl=SnCl 2+2H2OSn(OH)2+NaOHSn(OH)2+2NaOH=Na2SnO2+2H2O锡的氢氧化物SnCl4+NaOH(适量 )Sn4++4OH- =Sn(OH)4↓Sn(OH)4+HClSn(OH)4+4HCl=SnCl 4+4H2OSn(OH)4+NaOHSn(OH)4+4NaOH=Na2[Sn(OH) 6]铅的氢氧化物Pb(NO3) 2+NaOHPb2++2OH- =Pb(OH)2↓Pb(OH)2+HNO3Pb(OH)2+2HNO3= Pb(NO3) 2+2H2OPb(OH)2+NaOH(浓)Pb(OH)2+NaOH=Na[Pb(OH)3]锑的氢氧化物SbCl3+NaOH(适量 )Sb3++3OH- =Sb(OH)3↓Sb(OH)3+HClSb(OH)3+3HCl=SbCl 3+3H2OSb(OH)3+NaOH(6M)Sb(OH)3+NaOH=NaSbO2+2H2O铋的氢氧化物Bi(NO 3) 3+NaOHBi3++3OH- =Bi(OH) 3↓Bi(OH) 3+HClBi(OH) 3+3HCl=BiCl3+3H2OSb(OH)3+NaOH(浓)结论Sn(OH)2、Sn(OH)4呈两性;Pb(OH)2两性,以碱性为主, Sb(OH)3 两性偏碱, Bi(OH) 3呈弱碱性。2、锡、铅、锑、铋盐的水解项目实验步骤实验现象解释和 / 或反应式锑盐水解SbCl3 溶液 +pH试纸加水稀释 + pH 试纸SbCl 3+H2O=SbOCl↓+2HCl沉淀 +HCl,+水SbOCl+2HCl = SbCl3+H2O 锡盐水解SnCl2 溶液 +pH试纸加水稀释 + pH 试纸SnCl 2+H2O=Sn(OH)Cl↓+HCl沉淀 +HCl,+水Sn(OH)Cl+HCl = SnCl2+H2O 铅盐水解Pb(NO3) 2 溶液 +pH试纸加水稀释 + pH 试纸Pb(NO3) 2+H2O= Pb(OH)NO3↓+HNO3沉淀 +HNO3,+水Pb(OH)NO3+HNO3 = Pb(NO 3) 2+H2O 铋盐水解Bi(NO 3) 3 溶液 +pH试纸加水稀释 + pH 试纸Bi(NO 3) 3+H2O=SbONO3↓+2HNO3沉淀 +HNO3,+水SbONO3+2HNO3 = Bi(NO3) 3+H2O结论Sn(Ⅱ) 、Sb(Ⅲ) 、 Bi( Ⅲ) 都能发生水解,Pb( Ⅱ) 水解不显着。3、锡、铅、锑、铋的难溶物(1)难溶铅盐项目实验步骤实验现象解释和 / 或反应式氯化物Pb(NO3) 2+HClPb2++2Cl- =PbCl 2↓加热溶液+HCl(浓)PbCl 2+2HCl = H2[PbCl 4] 铬酸盐Pb(NO3) 2+K2CrO4Pb(NO3) 2+K2CrO4=PbCrO4↓+2KNO3沉淀 +HNO32PbCrO4+2HNO3= Pb(NO3) 2+PbCr2O7+H2O沉淀 +NaOHPbCrO4+4NaOH=Na2PbO2+Na2CrO4+2H2O 硫酸盐Pb(NO3) 2 +K 2SO4Pb(NO3) 2+K2SO4=PbSO4↓+2KNO3沉淀加浓 H2SO4加热PbSO4+H2SO4= Pb(HSO4) 2沉淀 +饱和 NaAc2PbSO4+2NaAc=[PbAc] 2SO4+Na2SO4碘化物Pb(NO3) 2+KI (适量)Pb2++2I- =PbI 2↓沉淀 +过量...