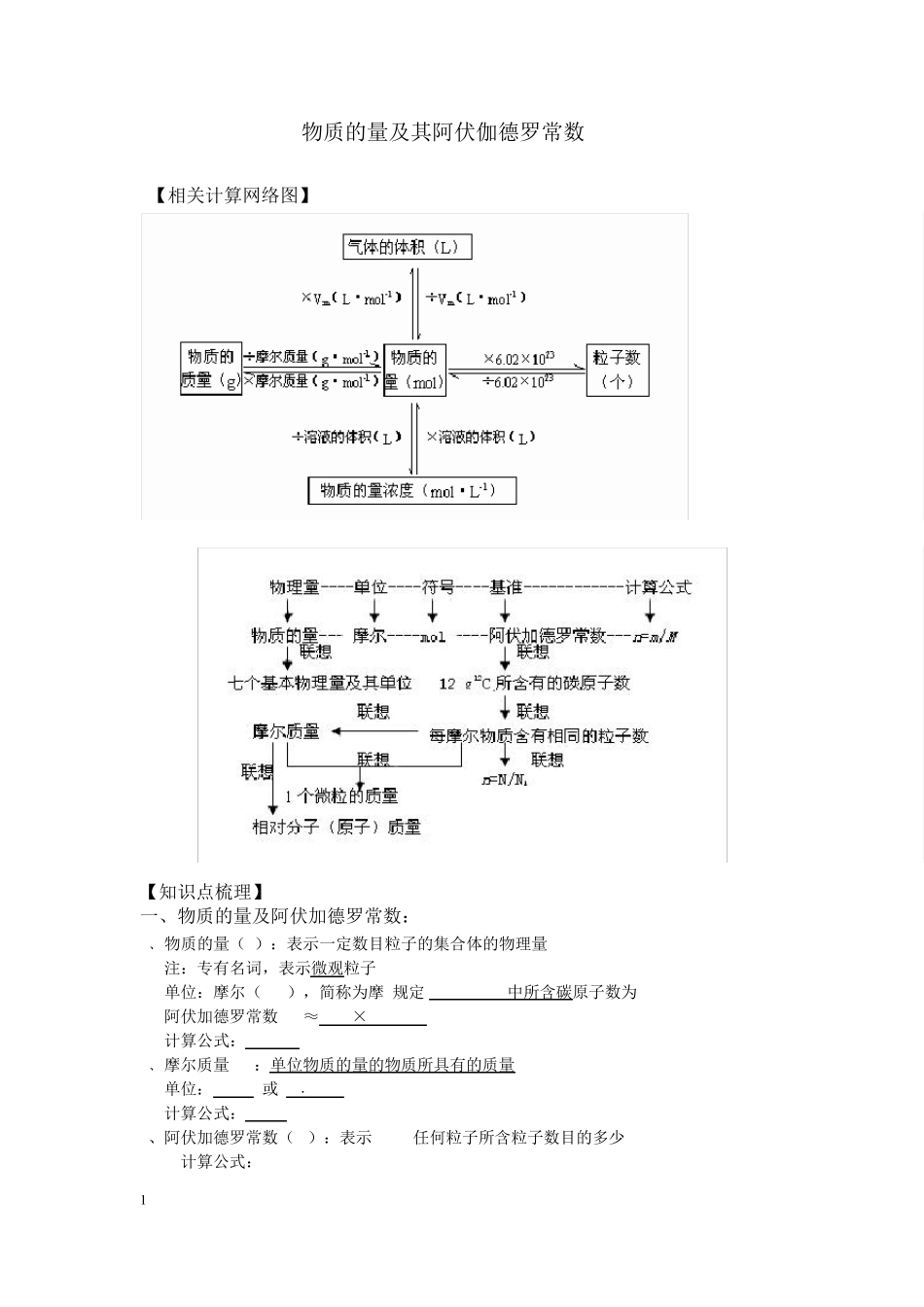
1 物质的量及其阿伏伽德罗常数 【相关计算网络图】 【知识点梳理】 一、物质的量及阿伏加德罗常数: 1﹑物质的量(n):表示一定数目粒子的集合体的物理量 注:专有名词,表示微观粒子 单位:摩尔(mol),简称为摩 规定0.012kg12C中所含碳原子数为1mol 阿伏加德罗常数NA ≈6.02×1023mol-1 计算公式:n=N/ NA 2﹑摩尔质量(M):单位物质的量的物质所具有的质量 单位:g/mol 或 g﹒mol-1 计算公式:M=m/n 3、阿伏加德罗常数(NA):表示1mol任何粒子所含粒子数目的多少 计算公式:NA = N/n 2 单位:mol-1 易错点讲解: 1.阿伏加德罗常数 是一个物理量,符号为“NA”,单位是 mol-1,是用来衡量物质中所含粒子的物质的量的标准。 (1)含义:实验测定 12g12C中碳原子的个数 (2)说明:①NA的基准是 12g碳-12中的原子个数 ②12C不仅是摩尔的基准对象,而且还是相对原子质量的基准 ③ NA是一个实验值,现阶段常取 6.02×1023作计算 ④要注意 NA与 6.02×1023的区别 2.阿伏加德罗常数常考知识点 (1)物质的状态:水在标准状态下不是气态;SO3在标准状况下是固态,在常温常压下是液态;标准状况下含碳原子数大于 4的烃不是气态。 (2)某些物质分子中原子的个数:稀有气体为单原子分子、臭氧为三原子分子、而白磷分子中则含有 4个磷原子。 (3)一些物质结构中化学键的数目:SiO2中共价键的数目等于 Si的数目的 2倍;Si(或金刚石)中的共价键数目等于 Si(或 C)数目的 2倍;CH4中共价键的数目等于 C数目的 4倍;1molP4分子中含有 6 mol 共价键等。 (4)特殊物质的摩尔质量:D2O的摩尔质量为 20g·mol-1;18O2的摩尔质量为 36g·mol-1。 (5)特殊物质在发生氧化还原反应得失电子数目的情况:1mol Na2O2只做 氧化剂时得到 2 mol电子。若既做氧化剂又做还原剂则转移 1mol电子。1mol Fe与强氧化剂(Cl2、硝酸等)反应时,失去 3mol电子,若与弱氧化剂反应则失去 2mol电子。 (6)有关标况下物质的状态:水、CCl4、C8H10等在标准状况下为液体或固体。 二﹑气体摩尔体积 1﹑物质体积大小取决于:物质的量、微粒的大小、微粒的距离 气体体积大小的决定因素:物质的量、微粒的距离 固体、液体体积大小的决定因素:物质的量、微粒的大小 2﹑气体摩尔体积(Vm):单位物质的量的气体所占的体积 单位:L/mol 或 L﹒mol-1 标况下 Vm=22.4 L﹒mol-1 , 常温常压下 Vm=24.8L﹒...