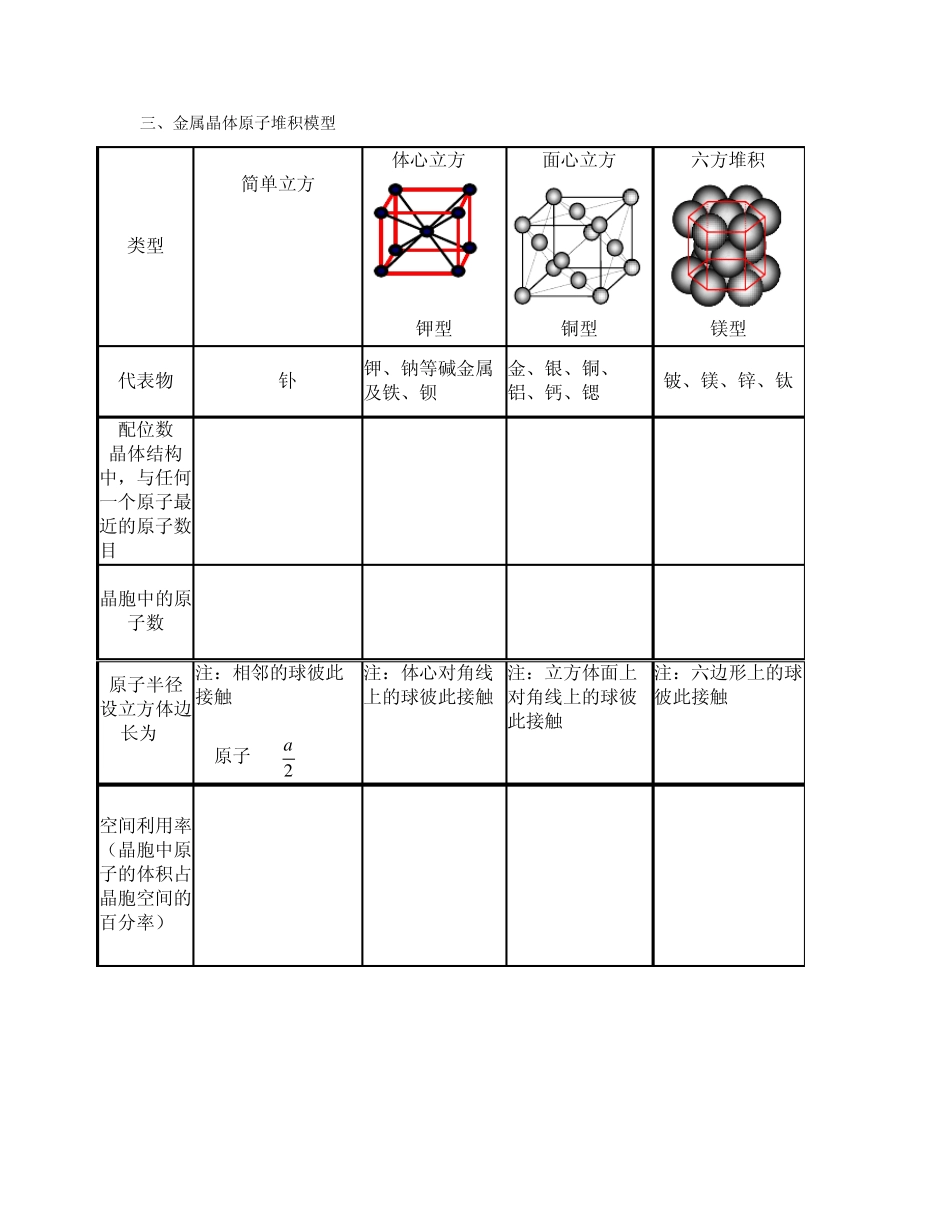
专题3微粒间作用力与物质性质 第一单元 金属键 金属晶体 一、金属键 1、金属晶体定义:由金属阳离子和自由电子通过金属键形成的具有一定几何外形的晶体。 晶体类型 金属晶体 离子晶体 原子晶体 分子晶体 构成粒子 金属阳离子 自由电子 阴阳离子 原子 分子 粒子间作用力 金属键 离子键 共价键 分子间作用力 2、金属的物理性质 ① 导电性:自由电子 ② 导热性:自由电子 ③ 延展性:金属原子的相对滑动 ④ 硬度和熔沸点:与金属键的强弱有关。(由库仑定律推导)一般规律:原子半径越小、价电子数越多(即阳离子的的电荷越多),金属键就越强,硬度就越大,熔沸点就越高。 二、合金的结构与性质 1、合金的定义 两种和两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质,叫做合金,合金属于混合物。 2、合金的特点①仍保留金属的化学性质,但物理性质改变很大;②熔点比各成份金属的都低;③强度、硬度比成分金属大;④有的抗腐蚀能力强;⑤导电性比成分金属差。 3、合金的种类: 防腐性优异的不锈钢、 储氢材料 LaNi5 合金、形状记忆合金、高强度的锰钢、高磁性的硅钢、航空材料钛合金。 三、金属晶体原子堆积模型 类型 简单立方 体心立方 钾型 面心立方 铜型 六方堆积 镁型 代表物 Po(钋) 钾、钠等碱金属及铁、钡 金、银、铜、铝、钙、锶 铍、镁、锌、钛 配位数 (晶体结构中,与任何一个原子最近的原子数目) 6 8 12 12 晶胞中的原子数 1 2 5 ------- 原子半径 设立方体边长为 a 注:相邻的球彼此接触 r(原子)= 2a 注:体心对角线上的球彼此接触 注:立方体面上对角线上的球彼此接触 注:六边形上的球彼此接触 空间利用率 (晶胞中原子的体积占晶胞空间的百分率) 52% 68% 74% 74% 第二单元 离子键 离子晶体 一、离子键 1、离子键的定义:使阴、阳离子结合成离子化合物的静电作用 【小结】:常见的离子化合物 活泼的金属元素(IA、IIA)和活泼的非金属元素(VIA、VIIA)形成的化合物。 活泼的金属元素和酸根离子(或氢氧根离子)形成的化合物 铵根和酸根离子(或活泼非金属元素离子)形成的盐。 【小结】:离子化合物电子式的书写 简单阴离子的电子式不但要表达出最外层所有电子数(包括得到的电子),而且用方括号“[ ]”括起来,并在右上角注明负电荷数 简单阳离子的电子式就是离子符号 离子化合物的电子式由阴...