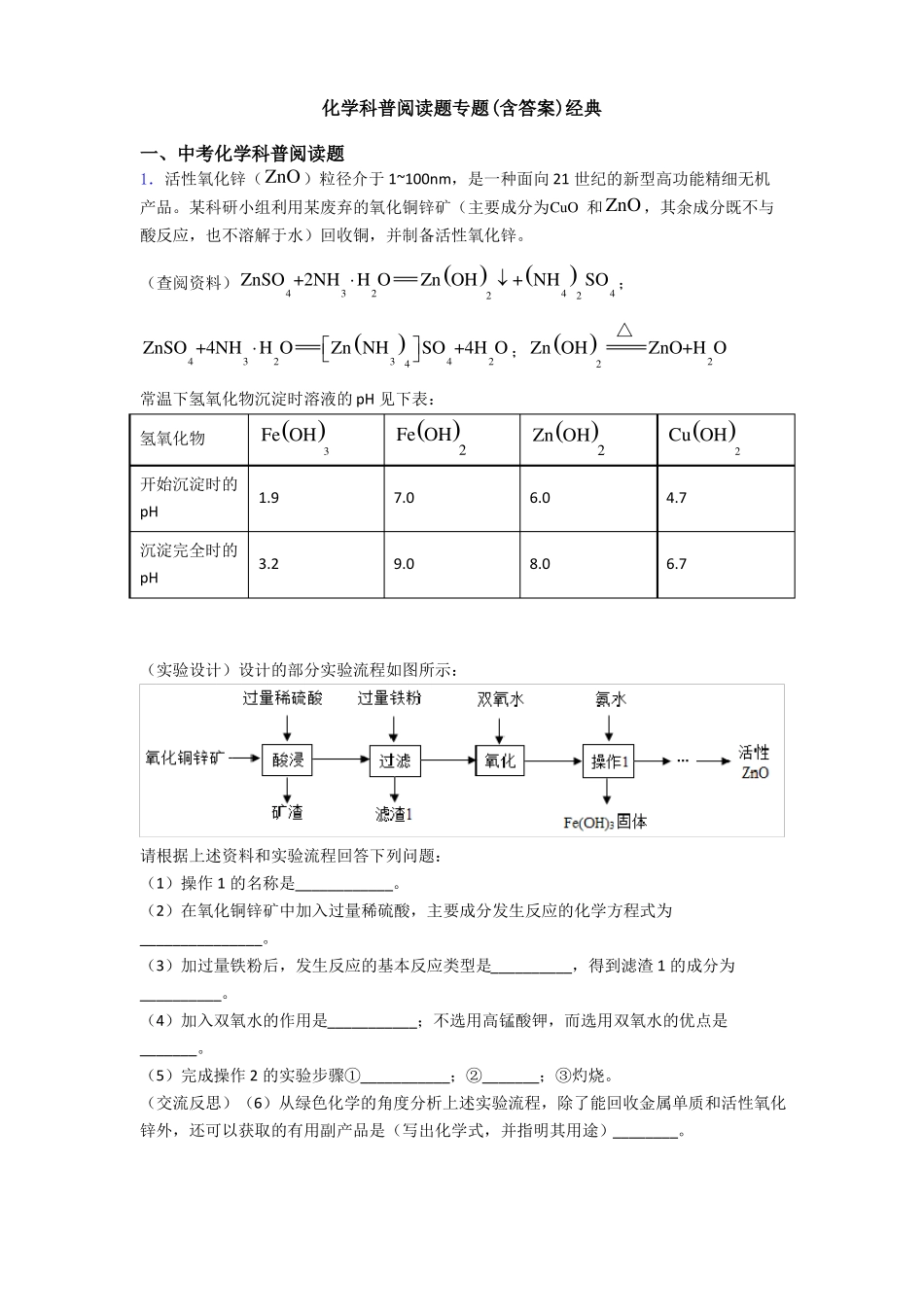
化学科普阅读题专题(含答案)经典一、中考化学科普阅读题1.活性氧化锌(ZnO )粒径介于 1~100nm,是一种面向 21 世纪的新型高功能精细无机产品。某科研小组利用某废弃的氧化铜锌矿(主要成分为CuO 和 ZnO ,其余成分既不与酸反应,也不溶解于水)回收铜,并制备活性氧化锌。(查阅资料)ZnSO4+2NH3 H2OZnOH2 +NH42 SO4 ;ZnSO4+4NH3 H2OSO4+4H2O ; ZnOH2ZnNH34 △ZnO+H2O常温下氢氧化物沉淀时溶液的 pH 见下表:氢氧化物开始沉淀时的pH沉淀完全时的pHFeOH31.9FeOH27.0ZnOH26.0CuOH24.73.29.08.06.7(实验设计)设计的部分实验流程如图所示:请根据上述资料和实验流程回答下列问题:(1)操作 1 的名称是____________。(2)在氧化铜锌矿中加入过量稀硫酸,主要成分发生反应的化学方程式为_______________。(3)加过量铁粉后,发生反应的基本反应类型是__________,得到滤渣 1 的成分为__________。(4)加入双氧水的作用是___________;不选用高锰酸钾,而选用双氧水的优点是_______。(5)完成操作 2 的实验步骤①___________;②_______;③灼烧。(交流反思)(6)从绿色化学的角度分析上述实验流程,除了能回收金属单质和活性氧化锌外,还可以获取的有用副产品是(写出化学式,并指明其用途)________。【答案】过滤CuO+H2SO4CuSO4+H2O ; ZnO+H2SO4ZnSO4+H2O置换反应 Cu、Fe将 FeSO 4( Fe 2 )氧化成Fe2 SO43 (Fe3 ),以便在后续操作中将溶液中的铁元素除去不引入较难除去的杂质加入适量稀硫酸,调节溶液的 pH 至 8.0过滤、洗涤、干燥Fe2O3 作颜料、NH42 SO4 作化肥【解析】【分析】【详解】实验设计:(1)操作 1 是使不溶性物质氢氧化铁和其他可溶性物质分离的过程,为过滤;(2)在氧化铜锌矿中加入过量稀硫酸,目的是使氧化铜和氧化锌完全反应进入溶液,主要成分发生反应的化学方程式为:CuO+H2SO4=CuSO4+H2O 、ZnO+H2SO4=ZnSO4+H2O ;(3)由于加入铁粉前是硫酸铜、硫酸锌以及剩余的硫酸的混合溶液,加入铁粉,反应的反应分别为:Fe+CuSO4=Cu+FeSO4 和Fe+H2SO4=FeSO4+H2 ,都是单质和化合物反应生成新的单质和新的化合物,为置换反应。反应后,由于加入的铁过量,所以滤渣含有剩余的 Fe ,同时还有生成的Cu 。(4)加入双氧水的作用是 FeSO 4( Fe 2 )氧化成Fe2 SO43 (Fe3 ),以便在后续操...