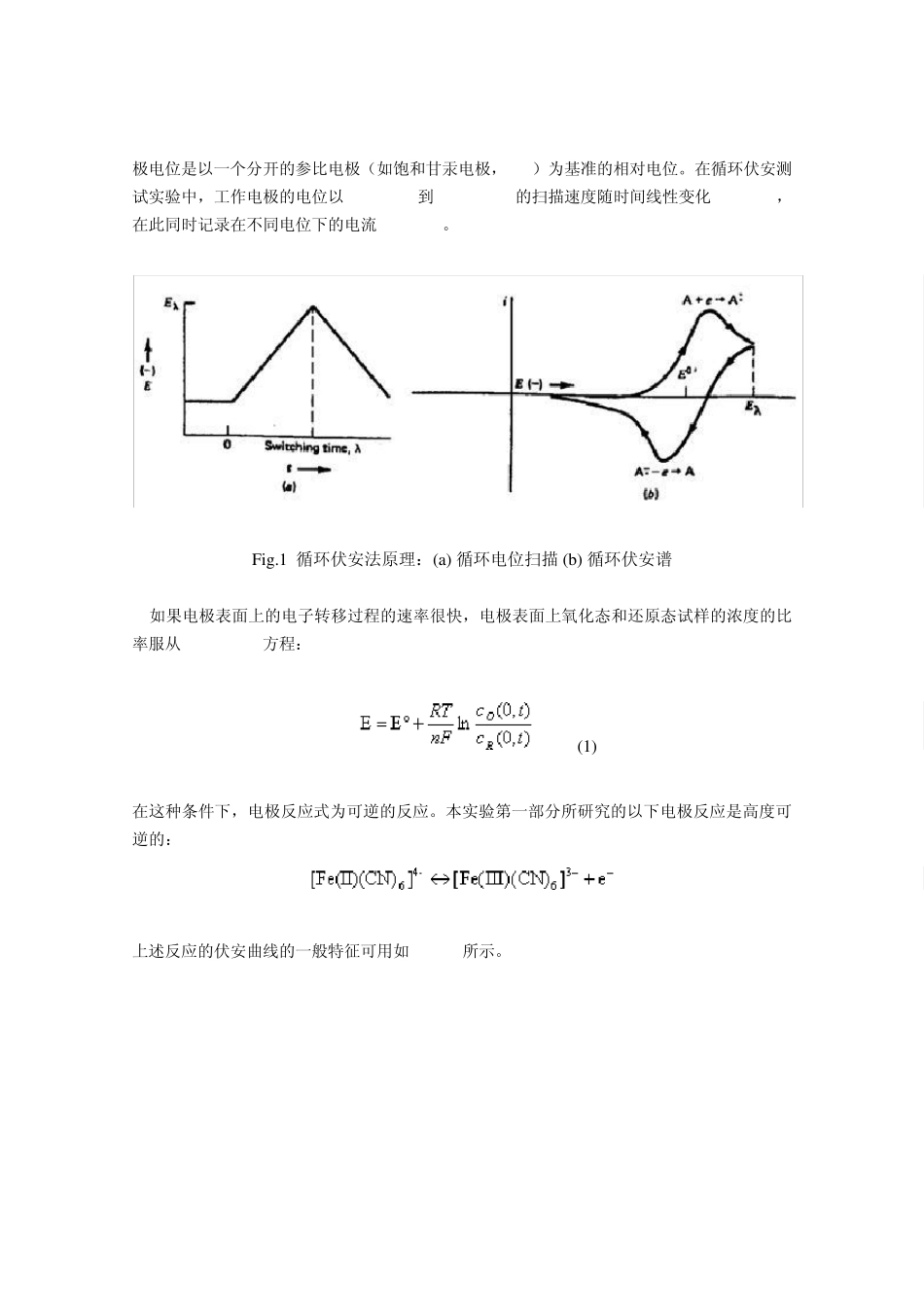
Ce3+/Ce4+氧化还原反应的循环伏安测试实验 (实验设计人 周德壁) 铈(Ce)是我国较丰富的稀土资源之一。Ce 在溶液中以Ce3+、Ce4+ 等不同价态的离子存在。Ce3+/Ce4+构成氧化还原对,其标准还原电位较高(E= 1.715 V)。从热力学的角度出发,铈的可溶盐的溶液可以作为高能氧化还原电池的正极材料。 有两个因素限制了铈在这方面的开发应用:(1)Ce 在水溶液中的溶解度较低;(2)与其相匹配的负极电解液的确定。对此,近来在国外已取得了一些突破。用甲基磺酸(MSA)配制铈的电解液已获得较为满意的溶解度。此外,用 Zn,Cr2+,V2+,Ti3+ 作负极材料也显示可行。从我国的资源利用及技术可行性出发,尽快开展以铈为正极材料的研究开发具有重要的意义。 循环伏安法是一种经典的电化学研究方法, 其工作原理涉及电化学领域多方面的较为成熟的理论。这种测试对设备没有特殊要求,且实验操作简便。.测试结果可以提供有关反应机理和反应动力学的丰富的信息。 在本实验中,学生将在教师的指导下,运用循环伏安等方法研究 Ce3+/Ce4+在电极上的氧化还原反应机理和动力学。通过实验工作,学生有机会运用电化学的基本理论知识,处理实际问题, 并能亲身领略化学电源的前沿科研课题。 一、实验目的与要求 在第一部分实验中,学生运用循环伏安方法对快速、可逆反应: 进行测定,并作数据处理。初步掌握循环伏安方法的运用,从实验结果获取有关反应行为的信息, 巩固有关电极反应可逆性、反应速率、反应动力学等电化学基本概念。 在第二部分实验中,学生运用循环伏安方法研究 Ce3+/Ce4+在电极上反应的动力学和机理;组装并测试电池的性能。初步掌握氧化还原电池的基本概念及结构,电池基本性能的测试方法。了解氧化还原概念与结构,以及国内外在这方面的最新进展。 要求: ① 学生复习电化学,循环伏安法的基本原理; ② 上网或通过其他途径,查阅有关稀土铈的物理化学性质,资源及应用现状; ③ 了解氧化还原电池的基本原理、基本结构以及研究开发的最新进展。 二、实验原理及步骤 在一个典型的循环伏安实验中,工作电极一般为浸在溶液中的固定电极。为了尽可能降低欧姆电阻,最好采用三电极系统。在三电极系统中,电流通过工作电极和对电极。工作电极电位是以一个分开的参比电极(如饱和甘汞电极,SCE)为基准的相对电位。在循环伏安测试实验中,工作电极的电位以10 mV/s 到 200 mV/s 的扫描速度随时间线性变化(Fig.1a),在...