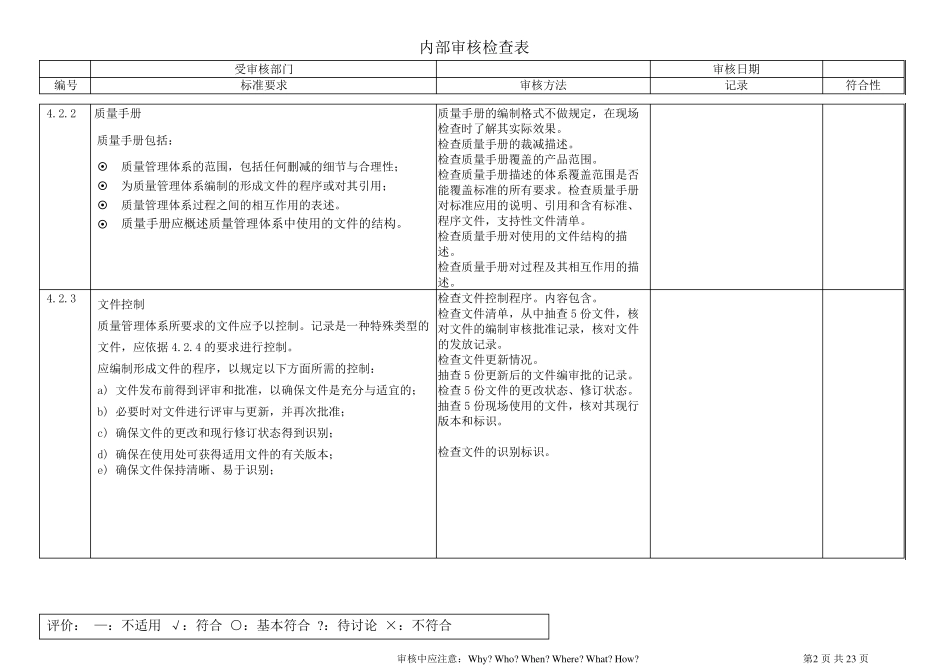
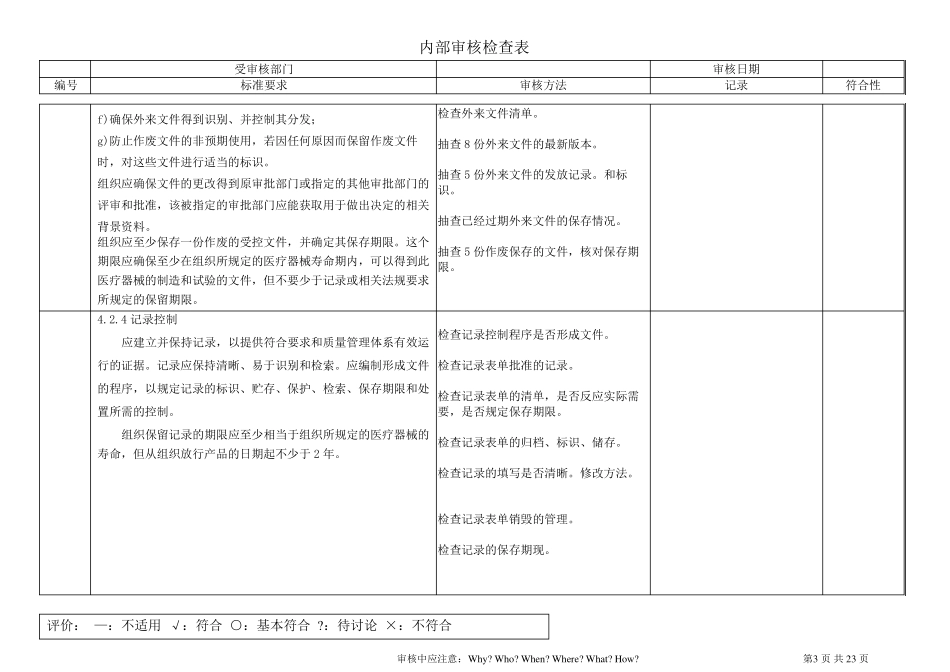
内部审核检查表 受审核部门 审核日期 编号 标准要求 审核方法 记录 符合性 评价: —:不适用 √:符合 ○:基本符合 ?:待讨论 ×:不符合 审核中应注意:Why? Who? When? Where? What? How? 第1 页 共 23 页 4.1 总要求 应建立质量管理体系,形成文件: 识别过程及其应用 确定过程顺序和作用; 确定准则和方法; 必要的资源和信息; 监视、测量和分析这些过程; 实施策划的结果和持续改进; 管理过程; 外包过程的控制和识别。 检查质量体系策划结果。 检查文件清单。 确认标准要求的程序文件是否覆盖。 检查质量体系过程图示。 检查过程描述和过程关系是否符合实际情况。 检查外包过程的描述。 4.2 4.2.1 文件要求 总则 质量管理体系文件应包括: 质量方针、质量目标 质量手册 形成文件的程序 所需的文件 记录 国家和地区法规规定的其他文件要求 应建立和保持一套文档,包括对每一型号/类型的医疗器械,产品规范的规定和对以下质量体系(过程和质量保证)的要求: ---- 完整生产过程,和 ---- 若需要,安全和服务过程或说明这些资料 的出 处 。 注:主 文档一般 包括:产品规范、生产规范、检验 规范、图纸 等 。 检查质量方针、质量目标、质量手册、程序文件、作业 指 导 书 是否形成。 确认文件结构 。 请 提 供 1 个 产品的主 文档。 检查主 文档内容 ,是否覆盖产品规范、检验 规范、生产规范、图纸 等 。 内部审核检查表 受审核部门 审核日期 编号 标准要求 审核方法 记录 符合性 评价: —:不适用 √:符合 ○:基本符合 ?:待讨论 ×:不符合 审核中应注意:Why? Who? When? Where? What? How? 第2 页 共 23 页 4.2.2 质量手册 质量手册包括: 质量管理体系的范围,包括任何删减的细节与合理性; 为质量管理体系编制的形成文件的程序或对其引用; 质量管理体系过程之间的相互作用的表述。 质量手册应概述质量管理体系中使用的文件的结构。 质量手册的编制格式不做规定,在现场检查时了解其实际效果。 检查质量手册的裁减描述。 检查质量手册覆盖的产品范围。 检查质量手册描述的体系覆盖范围是否能覆盖标准的所有要求。检查质量手册对标准应用的说明、引用和含有标准、程序文件,支持性文件清单。 检查质量手册对使用的文件结构的描...