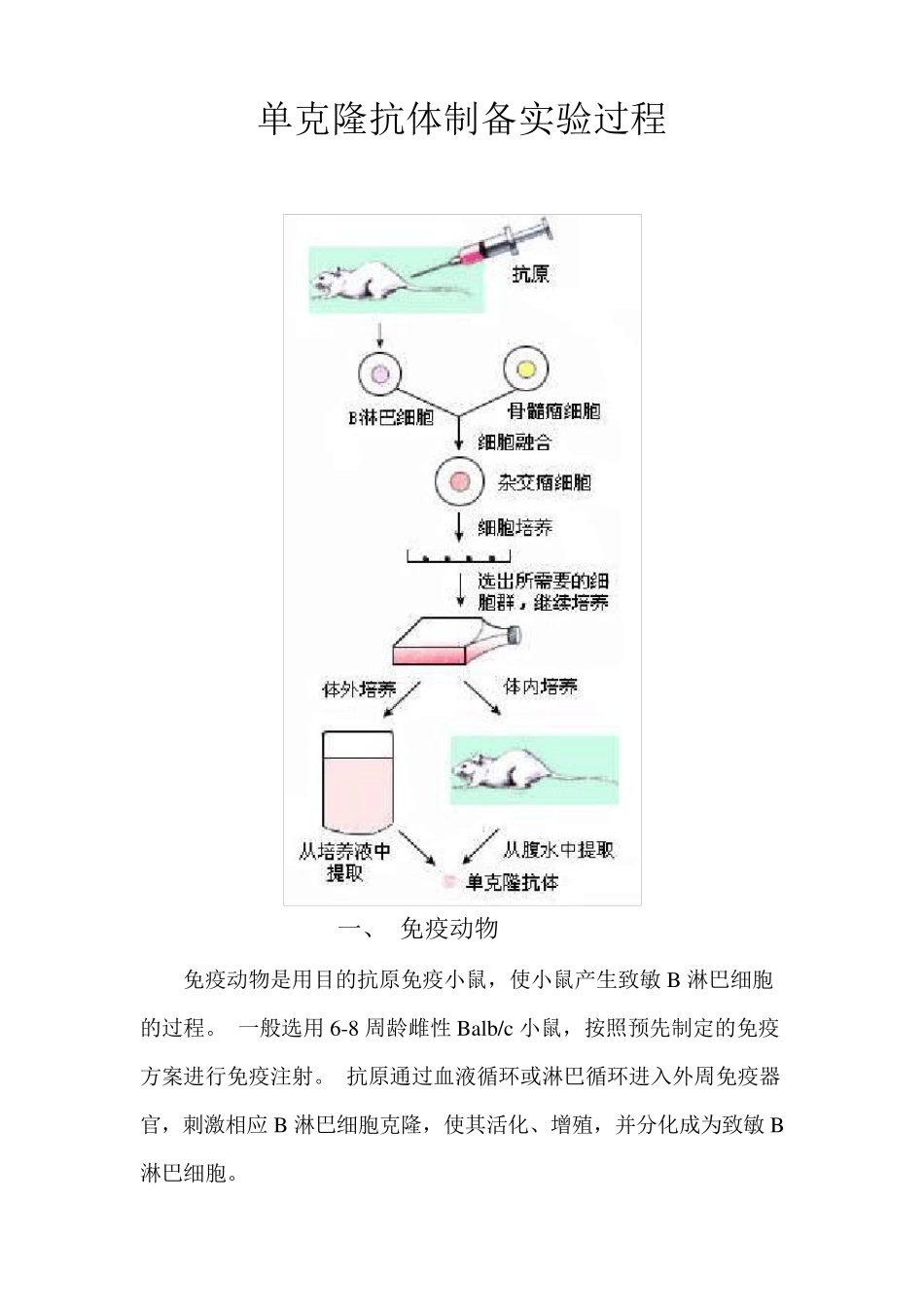
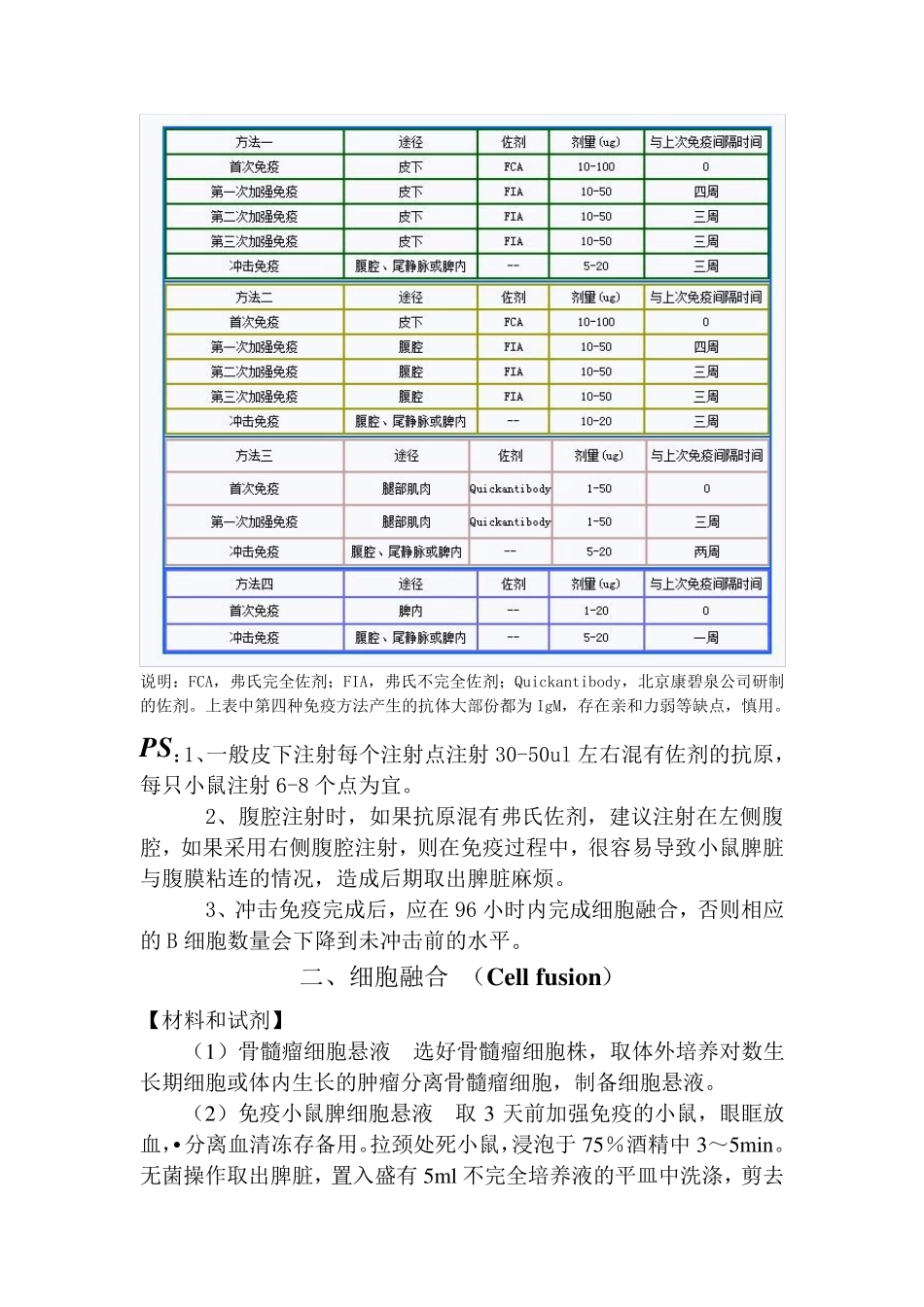
单克隆抗体制备实验过程 一、 免疫动物 免疫动物是用目的抗原免疫小鼠,使小鼠产生致敏 B 淋巴细胞的过程。 一般选用 6-8 周龄雌性 Balb/c 小鼠,按照预先制定的免疫方案进行免疫注射。 抗原通过血液循环或淋巴循环进入外周免疫器官,刺激相应 B 淋巴细胞克隆,使其活化、增殖,并分化成为致敏 B淋巴细胞。 说明:FCA,弗氏完全佐剂;FIA,弗氏不完全佐剂;Quickantibody,北京康碧泉公司研制的佐剂。上表中第四种免疫方法产生的抗体大部份都为IgM,存在亲和力弱等缺点,慎用。 PS:1、一般皮下注射每个注射点注射 30-50ul 左右混有佐剂的抗原,每只小鼠注射 6-8 个点为宜。 2、腹腔注射时,如果抗原混有弗氏佐剂,建议注射在左侧腹腔,如果采用右侧腹腔注射,则在免疫过程中,很容易导致小鼠脾脏与腹膜粘连的情况,造成后期取出脾脏麻烦。 3、冲击免疫完成后,应在96 小时内完成细胞融合,否则相应的B 细胞数量会下降到未冲击前的水平。 二、细胞融合 (Cell fu sion) 【材料和试剂】 (1)骨髓瘤细胞悬液 选好骨髓瘤细胞株,取体外培养对数生长期细胞或体内生长的肿瘤分离骨髓瘤细胞,制备细胞悬液。 (2)免疫小鼠脾细胞悬液 取 3 天前加强免疫的小鼠,眼眶放血,•分离血清冻存备用。拉颈处 死 小鼠,浸 泡 于 75% 酒 精 中3~ 5min。无 菌 操 作 取出脾脏,置 入 盛 有 5ml 不完全培养液的平皿 中洗 涤 ,剪 去周围的结缔组织,将脾脏移入另一盛有5ml 不完全培养液的平皿中的钢网上,先用剪刀剪成3~5 个小块,然后用注射器内芯研磨。将脾脏细胞悬液移至50ml 离心管中,加不完全培养液50ml,1000r/min离心5min,弃上清,再以同法洗涤离心一次。然后将沉淀细胞重新悬浮于10ml 不完全培养液中,计活细胞数,一般一只小鼠可得0.5~2×108 个脾细胞。 (3)饲养细胞 将小鼠致死、体表消毒和固定后,用消毒剪镊从后腹掀起腹部皮肤,暴露腹膜。用酒精棉球擦拭腹膜消毒。用注射器注射10ml 不完全培养基至腹腔,注意避免穿入肠管。右手固定注射器,使针头留置在腹腔内,左手持酒精棉球轻轻按摩腹部 1 分钟,随后吸出注入的培养液。1000r/min 离心5-10 分钟,弃上清。先用5ml HAT 培养基将沉淀细胞悬浮,根据细胞计数结果,补加HAT 培养基,使细胞浓度为2×105/ml,备用。 (4)主要试剂的配制 ①细胞培养基杂交瘤技术中使用的细胞培养基主要有RPMI-1640 或DMEM(Dulber...