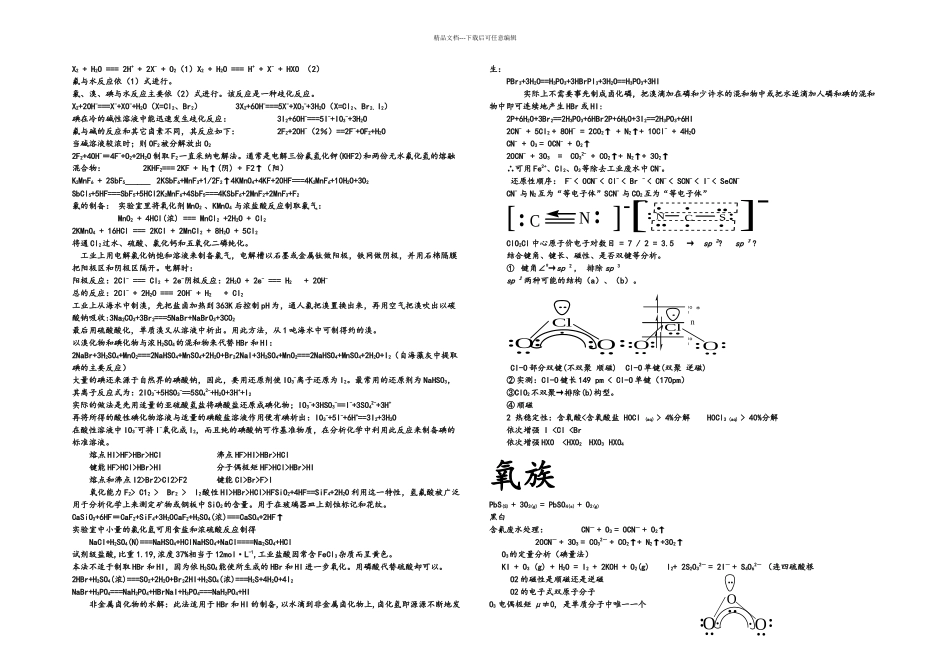
精品文档---下载后可任意编辑X2 + H2O === 2H+ + 2X- + O2(1)X2 + H2O === H+ + X- + HXO (2)氟与水反应依(1)式进行。氯、溴、碘与水反应主要依(2)式进行。该反应是一种歧化反应。X2+2OH-===X-+XO-+H2O(X=Cl2、Br2) 3X2+6OH-===5X-+XO3-+3H2O(X=Cl2、Br2、I2)碘在冷的碱性溶液中能迅速发生歧化反应: 3I2+6OH-===5I-+IO3-+3H2O氟与碱的反应和其它卤素不同,其反应如下: 2F2+2OH-(2%)==2F-+OF2+H2O当碱溶液较浓时;则 OF2被分解放出 O22F2+4OH-=4F-+O2+2H2O 制取 F2一直采纳电解法。通常是电解三份氟氢化钾(KHF2)和两份无水氟化氢的熔融混合物: 2KHF2=== 2KF + H2↑(阴) + F2↑(阳) K2MnF6 + 2SbF5______ 2KSbF6+MnF3+1/2F2↑4KMnO4+4KF+20HF===4K2MnF6+10H2O+3O2SbCl5+5HF===SbF5+5HCl2K2MnF6+4SbF5===4KSbF6+2MnF2+2MnF3+F2氯的制备: 实验室里将氧化剂 MnO2 、KMnO4 与浓盐酸反应制取氯气: MnO2 + 4HCl(浓) === MnCl2 +2H2O + Cl2 2KMnO4 + 16HCl === 2KCl + 2MnCl2 + 8H2O + 5Cl2将通 Cl2过水、硫酸、氯化钙和五氧化二磷纯化。 工业上用电解氯化钠饱和溶液来制备氯气,电解槽以石墨或金属钛做阳极,铁网做阴极,并用石棉隔膜把阳极区和阴极区隔开。电解时:阳极反应:2Cl- === Cl2 + 2e-阴极反应:2H2O + 2e- === H2 + 2OH-总的反应:2Cl- + 2H2O === 2OH- + H2 + Cl2 工业上从海水中制溴,先把盐卤加热到 363K 后控制 pH 为,通人氯把溴置换出来,再用空气把溴吹出以碳酸钠吸收:3Na2CO3+3Br2===5NaBr+NaBrO3+3CO2 最后用硫酸酸化,单质溴又从溶液中析出。用此方法,从 1 吨海水中可制得约的溴。以溴化物和碘化物与浓 H2SO4的混和物来代替 HBr 和 HI:2NaBr+3H2SO4+MnO2===2NaHSO4+MnSO4+2H2O+Br22NaI+3H2SO4+MnO2===2NaHSO4+MnSO4+2H2O+I2(自海藻灰中提取碘的主要反应)大量的碘还来源于自然界的碘酸钠,因此,要用还原剂使 IO3-离子还原为 I2。最常用的还原剂为 NaHSO3,其离子反应式为:2IO3-+5HSO3-==5SO42-+H2O+3H++I2实际的做法是先用适量的亚硫酸氢盐将碘酸盐还原成碘化物;IO3-+3HSO3-==I-+3SO42-+3H+再将所得的酸性碘化物溶液与适量的碘酸盐溶液作用便有碘析出:IO3-+5I-+6H+==3I2+3H2O在酸性溶液中 IO3-可将 I-氧化成 I2,而且纯的碘酸钠可作基准物质,在分析化学中利用此反应来制备碘的标准溶液。熔点 HI>H...