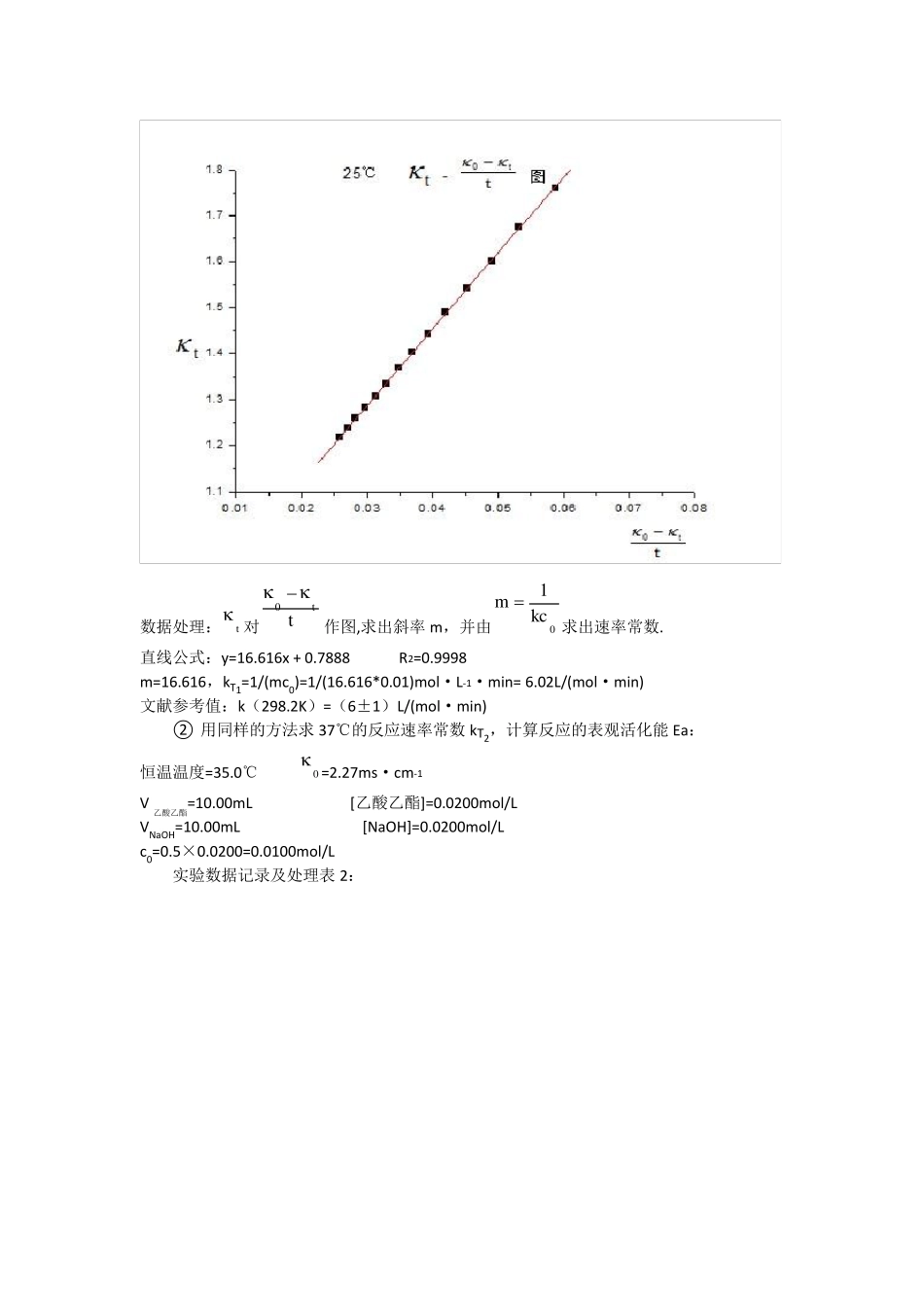
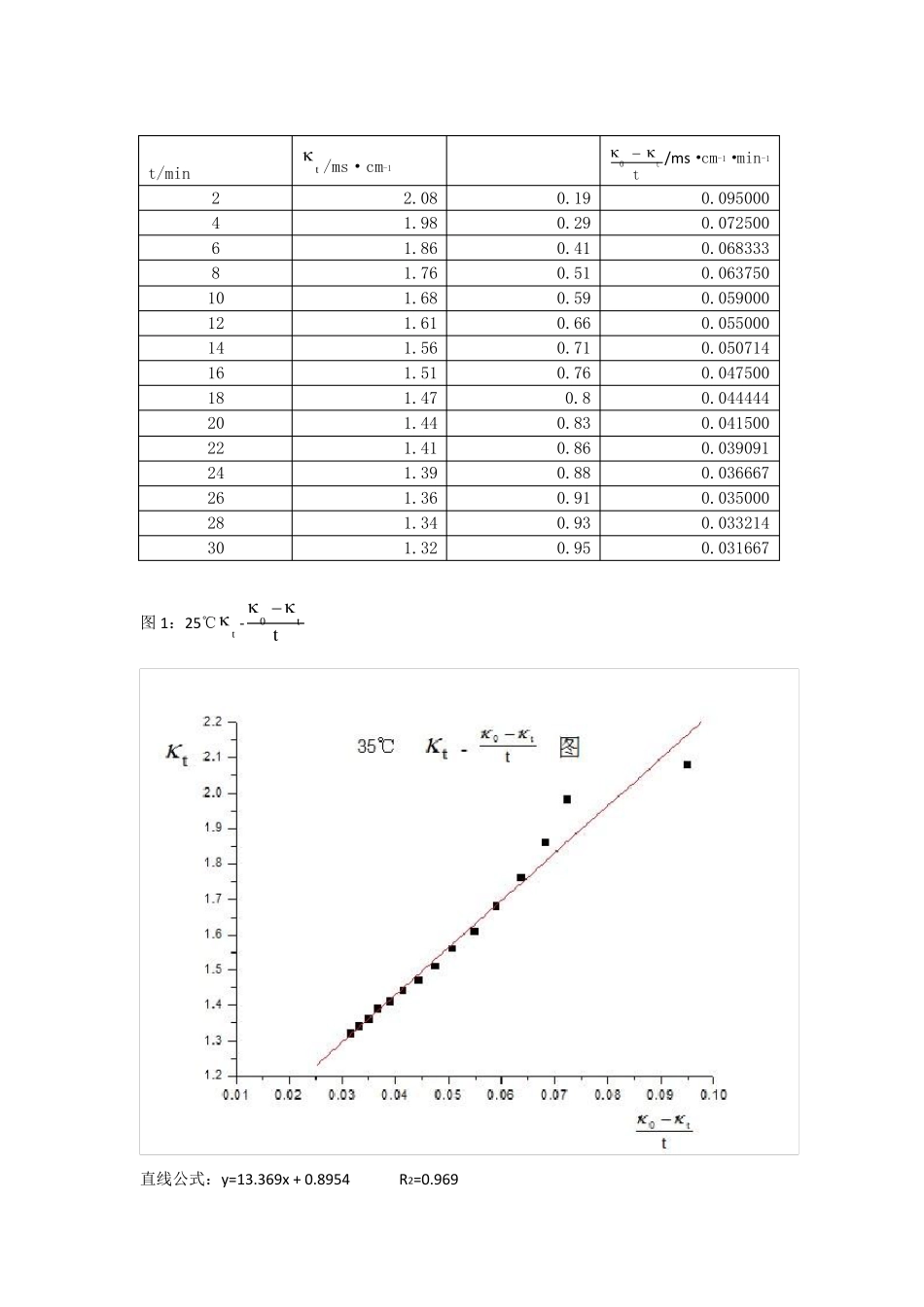
【数据处理】 ① 25℃的反应速率常数kT1,将实验数据及计算结果填入下表: 恒温温度=24.9℃ 0 =1.994ms·cm-1 V乙酸乙酯=10.00mL [乙酸乙酯]=0.0200mol/L VNaOH=10.00mL [NaOH]=0.0200mol/L c0=0.5×0.0200=0.01mol/L 实验数据记录及处理表1: t/min t /ms·cm-1 tt0/ms·cm-1·min-1 2 1.835 0.159 0.079500 4 1.759 0.235 0.058750 6 1.675 0.319 0.053167 8 1.602 0.392 0.049000 10 1.542 0.452 0.045200 12 1.49 0.504 0.042000 14 1.444 0.55 0.039286 16 1.404 0.59 0.036875 18 1.368 0.626 0.034778 20 1.335 0.659 0.032950 22 1.306 0.688 0.031273 24 1.281 0.713 0.029708 26 1.259 0.735 0.028269 28 1.237 0.757 0.027036 30 1.217 0.777 0.025900 图 1:25℃t -tt0 由于第一个数据偏离其它数据太多,有明显的误差,所以舍去。 数据处理:t 对tt0 作图,求出斜率m,并由0kc1m 求出速率常数. 直线公式:y=16.616x + 0.7888 R2=0.9998 m=16.616,kT1=1/(mc0)=1/(16.616*0.01)mol·L-1·min= 6.02L/(mol·min) 文献参考值:k(298.2K)=(6±1)L/(mol·min) ② 用同样的方法求37℃的反应速率常数kT2,计算反应的表观活化能 Ea: 恒温温度=35.0℃ 0 =2.27ms·cm-1 V乙酸乙酯=10.00mL [乙酸乙酯]=0.0200mol/L VNaOH=10.00mL [NaOH]=0.0200mol/L c0=0.5×0.0200=0.0100mol/L 实验数据记录及处理表 2: t/min t /ms·cm-1 tt0/ms·cm-1·min-1 2 2.08 0.19 0.095000 4 1.98 0.29 0.072500 6 1.86 0.41 0.068333 8 1.76 0.51 0.063750 10 1.68 0.59 0.059000 12 1.61 0.66 0.055000 14 1.56 0.71 0.050714 16 1.51 0.76 0.047500 18 1.47 0.8 0.044444 20 1.44 0.83 0.041500 22 1.41 0.86 0.039091 24 1.39 0.88 0.036667 26 1.36 0.91 0.035000 28 1.34 0.93 0.033214 30 1.32 0.95 0.031667 图 1:25℃t -tt0 直线公式:y=13.369x + 0.8954 R2=0.969 m=13.369,kT2=1/(mc0)=1/(13.369*0.01)mol·L-1·min= 7.48L/(mol·min) 文献参考值:k(308.2K)=(10±2)L/(mol·min) b.计算反应的表观活化能:文献值:Ea=46.1kJ/mol ln(kT2/kT1)=Ea/R·(1/T1-1/T2) ∴Ea=Rln(kT2/kT1)/[T1T2/(T2-T1)...