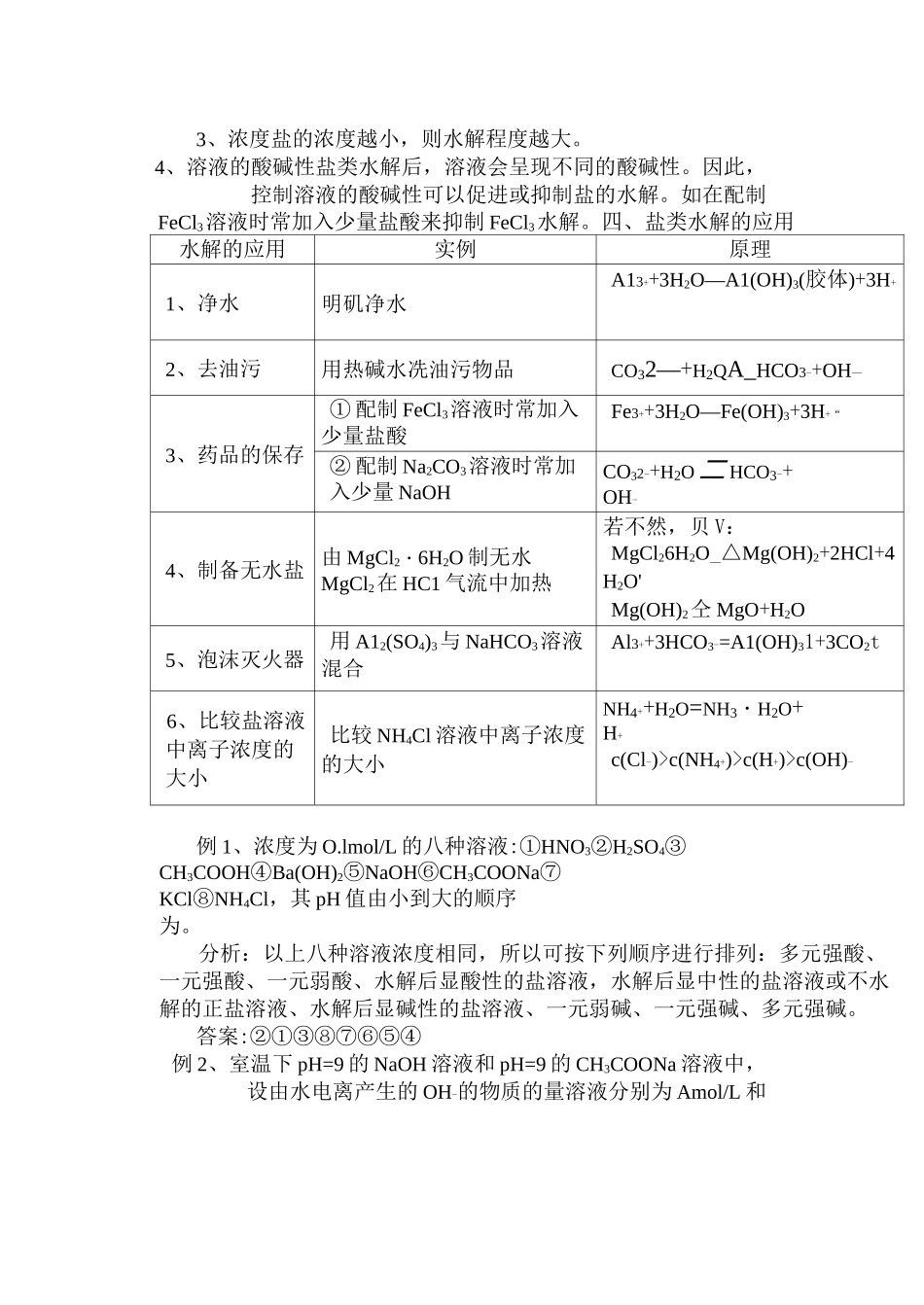
一、盐类水解的实质盐电离出来的某些离子(一般是弱酸根离子或弱碱阳离子)跟水电离出来的 H+或 0H-结合生成了弱电解质,促使水的电离平衡发生移动,结果溶液中 c(H+)、c(OH-)发生了相对改变,从而使溶液呈一定的酸碱性。盐类的水解程度一般都很小,且是可逆反应,书写水解方程式时要用“”表示。因水解是微弱的,平衡时生成的弱电解很少,所以一般不会产生沉淀和气体,生成物不应加沉淀符号 ( I ) 或气体符号 ( f ) 。 二、盐类水解的类型和规律1、强碱弱酸盐水解,溶液呈碱性,pH>7,女口 CH3COONa、NaCO3等。多元弱酸根离子是分步水解的,且第一步水解程度>>第二步水解程度,溶液的酸碱性主要决定于第一步水解程度。如Na2CO3 在 水 溶 液 中 水 解 应 分 两 步 写 : ① CO32-+H2OAHCO3-+OH- , ② HCO3-+H2OH2CO3+OH-多元弱酸的酸式根离子同时具备电离和水解两种趋势:HR-H++R2-(电离,呈酸性),HR-+H2OH2R+OH-(水解,呈碱性),这需要具体分析。很显然如果电离趋势占优势,则显酸性 ,如:H2PO4-、HSO3-,如果水解趋势占优势,则显碱性,如:HCO3-、HS-、HPO42-等。2、强酸弱碱盐水解,溶液呈酸性,pH<7,如 NH4C1、A12(SO4)33、强酸强碱盐不水解,溶液呈中性,pH=7,如 NaCl、KNO34、弱酸弱碱盐水解,溶液呈什么性由水解生成的弱酸、弱碱的相对强弱比较来决定。当遇到某些弱酸弱碱盐两种离子都发生水解,应在同.一.离子方程式中表示,而且因强烈水解,若是水解产物中有气体或难溶物质或易分解物质的话,这类水解往往能进行到底,这样水解方程式应用“=”号表示,并在生 成 的 沉 淀 和 气 体 的 后 面 标 上 “ I” 或 “ f” 。 如 2A13++3S2-+6H2O=2Al(OH)3I+3H2S 仁 5、三大水解规律。三、影响盐类水解的因素1、盐类本身的性质这是影响盐类水解的内在因素。组成盐的酸或碱越弱,盐的水解程度越大,其盐溶液的酸性或碱性就越强。2、温度由于盐的水解作用是中和反应的逆反应,所以盐的水解是吸热反应,温度升高,水解程度增大。3、浓度盐的浓度越小,则水解程度越大。4、溶液的酸碱性盐类水解后,溶液会呈现不同的酸碱性。因此,控制溶液的酸碱性可以促进或抑制盐的水解。如在配制FeCl3溶液时常加入少量盐酸来抑制 FeCl3水解。四、盐类水解的应用水解的应用实例原理1、净水明矶净水A13++3H2O—A1(OH)3(胶体)+3H+2、去油污用热碱水冼油污物品CO32—+H2QA_HCO3-+OH—3、...